Ugljikovi oksidi: kemija, ocjena 8
Sve što nas okružuje sastoji se od spojeva različitih kemijskih elemenata. Udahnemo ne samo zrak, već složeni organski spoj koji sadrži kisik, dušik, vodik, ugljični dioksid i druge potrebne komponente. Utjecaj mnogih od tih elemenata na ljudski organizam posebno i na život na Zemlji kao cjelini još nije u potpunosti istražen. Kako bi se razumjeli procesi međusobnog djelovanja elemenata, plinova, soli i drugih formacija, predmet “Kemija” uveden je u školski tečaj. 8. razred je početak nastave kemije prema odobrenom općem obrazovnom programu.
Jedan od najčešćih spojeva u Zemljinoj kori iu atmosferi je oksid. Oksid je spoj bilo kojeg kemijskog elementa s atomom kisika. Čak je i izvor života na Zemlji - voda, vodikov oksid. No, u ovom članku ne govorimo o oksidima općenito, nego o jednom od najčešćih spojeva - ugljičnom monoksidu. Ovi spojevi su dobiveni spajanjem atoma kisika i ugljika. Ovi spojevi mogu sadržavati različite količine ugljikovih atoma i kisika, međutim, treba razlikovati dva glavna spoja ugljika s kisikom: ugljikov monoksid i ugljični dioksid.
Kemijska formula i metoda za proizvodnju ugljičnog monoksida
Koja je njegova formula? Ugljični monoksid se lako pamti - CO. Molekula ugljikovog monoksida formirana je trostrukom vezom, te stoga ima prilično visoku čvrstoću veze i ima vrlo malu internuklearnu udaljenost (0,1128 nm). Energija rupture ovog kemijskog spoja je 1076 kJ / mol. Trostruka veza nastaje zbog činjenice da ugljični element u svojoj atomskoj strukturi ima p-orbitalu koju ne zauzimaju elektroni. Ova okolnost stvara mogućnost da atom ugljika postane akceptor elektronskog para. A atom kisika, naprotiv, ima jedan neraspareni par elektrona na jednom od p-orbitala, te stoga ima sposobnosti elektron-donora. Kada se ta dva atoma kombiniraju, uz dvije kovalentne veze, pojavljuje se treća - donor-akceptorska kovalentna veza. 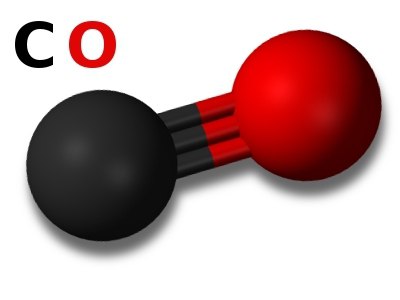
Postoje različiti načini dobivanja CO. Jedan od najjednostavnijih je prijenos ugljičnog dioksida preko vrućeg ugljena. U laboratorijskim uvjetima, ugljik monoksid se proizvodi slijedećom reakcijom: mravlja kiselina se zagrijava sumpornom kiselinom, koja odvaja mravlju kiselinu od vode i ugljičnog monoksida.
CO se također oslobađa kad se zagrijava oksalna kiselina i sumporna kiselina.
Fizikalna svojstva CO
Ugljični monoksid (2) ima sljedeća fizikalna svojstva - to je bezbojni plin koji nema izražen miris. Svi vanjski mirisi koji se pojavljuju tijekom curenja ugljičnog monoksida su proizvodi razgradnje organskih nečistoća. Mnogo je lakši od zraka, iznimno otrovan, vrlo slabo topljiv u vodi i karakteriziran je visokim stupnjem zapaljivosti.
Najvažnije svojstvo CO je njegov negativni učinak na ljudsko tijelo. Trovanje ugljičnim monoksidom može biti smrtonosna. Detaljnije o učincima ugljičnog monoksida na ljudsko tijelo bit će opisano u nastavku.
Kemijska svojstva CO
Glavne kemijske reakcije u kojima se mogu koristiti ugljikovi oksidi (2) su redoks reakcija kao i reakcija adicije. Redoks reakcija se izražava u sposobnosti CO da reducira metal iz oksida miješanjem s daljnjim zagrijavanjem.
Pri interakciji s kisikom nastaje ugljični dioksid s oslobađanjem značajne količine topline. Ugljični monoksid gori plavičastim plamenom. Vrlo važna funkcija ugljičnog monoksida je njegova interakcija s metalima. Kao rezultat takvih reakcija nastaju karbonili metala, od kojih je velika većina kristalnih tvari. Koriste se za proizvodnju ultra čistih metala, kao i za nanošenje metalnih premaza. Usput, karbonili imaju dobru reputaciju kao katalizatori za kemijske reakcije.
Kemijska formula i metoda za proizvodnju ugljičnog dioksida
Ugljični dioksid, ili ugljični dioksid, ima kemijsku formulu CO 2 . Struktura molekule se donekle razlikuje od strukture CO. U toj formaciji, ugljik ima oksidacijsko stanje +4. Struktura molekule je linearna i stoga nepolarna. Molekula CO 2 nema takvu jaku snagu kao CO. Zemljina atmosfera sadrži oko 0,03% ugljičnog dioksida po ukupnom volumenu. Povećanje ovog pokazatelja uništava ozonski omotač Zemlje. U znanosti se ovaj fenomen naziva učinak staklenika.
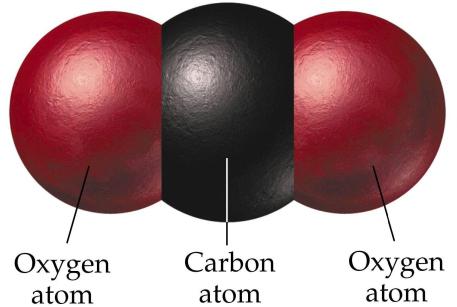
Ugljikov dioksid se može dobiti na različite načine. U industriji, nastaje kao rezultat sagorijevanja dimnih plinova. Može biti nusprodukt u procesu proizvodnje alkohola. Može se dobiti u procesu razgradnje zraka u glavne komponente, kao što su dušik, kisik, argon i drugi. U laboratorijskim uvjetima, ugljični monoksid (4) može se dobiti u procesu sagorijevanja vapnenca, a kod kuće se ugljični dioksid može ekstrahirati reakcijom limunske kiseline i sode bikarbone. Usput rečeno, na samom početku proizvodnje proizvedena su gazirana pića.
CO 2 Fizička svojstva
 Ugljični dioksid je bezbojna plinovita tvar bez karakterističnog jakog mirisa. Zbog visoke brzine oksidacije, ovaj plin ima blago kiselinski okus. Ovaj proizvod ne podržava proces izgaranja, jer je i sam rezultat gorenja. Uz povišenu koncentraciju ugljičnog dioksida, osoba gubi sposobnost disanja, što je smrtonosno. Više pojedinosti o učincima ugljičnog dioksida na ljudsko tijelo bit će opisano u nastavku. CO 2 je mnogo teži od zraka i savršeno je topljiv u vodi, čak i na sobnoj temperaturi.
Ugljični dioksid je bezbojna plinovita tvar bez karakterističnog jakog mirisa. Zbog visoke brzine oksidacije, ovaj plin ima blago kiselinski okus. Ovaj proizvod ne podržava proces izgaranja, jer je i sam rezultat gorenja. Uz povišenu koncentraciju ugljičnog dioksida, osoba gubi sposobnost disanja, što je smrtonosno. Više pojedinosti o učincima ugljičnog dioksida na ljudsko tijelo bit će opisano u nastavku. CO 2 je mnogo teži od zraka i savršeno je topljiv u vodi, čak i na sobnoj temperaturi.
Jedno od najzanimljivijih svojstava ugljičnog dioksida je da nema tekuće agregatno stanje pri normalnom atmosferskom tlaku. Međutim, ako je utjecaj na strukturu ugljičnog dioksida izložen temperaturi od -56,6 ° C i tlaku od oko 519 kPa, tada se pretvara u bezbojnu tekućinu.
Uz značajno smanjenje temperature, plin je u stanju tzv. "Suhog leda" i isparava na temperaturi višoj od -78 ° C.
Kemijska svojstva CO 2
Tipična su kemijska svojstva ugljičnog monoksida (4), čija je formula CO 2 kiseli oksid i ima sva svoja svojstva.
1. U interakciji s vodom nastaje ugljična kiselina koja ima slabu kiselost i nisku stabilnost u otopinama.
2. U interakciji s alkalijama, ugljični dioksid tvori odgovarajuću sol i vodu.
3. Tijekom interakcije s oksidima aktivnog metala potiče se stvaranje soli.
4. Ne podržava proces gorenja. Samo određeni aktivni metali, kao što je litij, kalij, natrij, mogu aktivirati ovaj proces.
Utjecaj ugljičnog monoksida na ljudsko tijelo
 Vratimo se glavnom problemu svih plinova - utjecaju na ljudski organizam. Ugljični monoksid spada u skupinu izuzetno opasnih plinova. Za ljude i životinje, to je iznimno jaka otrovna tvar koja, ako se proguta, ozbiljno utječe na krv, živčani sustav tijela i mišiće (uključujući srce).
Vratimo se glavnom problemu svih plinova - utjecaju na ljudski organizam. Ugljični monoksid spada u skupinu izuzetno opasnih plinova. Za ljude i životinje, to je iznimno jaka otrovna tvar koja, ako se proguta, ozbiljno utječe na krv, živčani sustav tijela i mišiće (uključujući srce).
Ugljični monoksid u zraku se ne može prepoznati, jer ovaj plin nema jasan miris. To je ono što je on opasan. Jednom u ljudskom tijelu kroz pluća, ugljični monoksid aktivira svoju destruktivnu aktivnost u krvi i počinje interakciju s hemoglobinom stotinama puta brže od kisika. Kao rezultat, pojavljuje se vrlo otporna tvar koja se naziva karboksihemoglobin. To ometa isporuku kisika iz pluća u mišiće, što dovodi do gladovanja tkiva u mišićima. Posebno ozbiljno pogođen ovim mozgom.
Zbog nemogućnosti prepoznavanja trovanja ugljičnim monoksidom kroz njuh, trebali biste znati neke od glavnih simptoma koji se javljaju u ranim fazama:
- vrtoglavica, praćena glavoboljom;
- tinitus i treperenje pred očima;
- lupanje srca i kratkoća daha;
- crvenilo lica.
U budućnosti, žrtva trovanja pojavljuje se teška slabost, ponekad povraćanje. U teškim slučajevima trovanja mogući su nenamjerni napadaji, praćeni daljnjim gubitkom svijesti i komom. Ako pacijentu nije pružena odgovarajuća medicinska skrb na vrijeme, onda je smrt moguća.
Utjecaj ugljičnog dioksida na ljudsko tijelo
Ugljikovi oksidi s kiselinom +4 pripadaju odsječku asfiksirajućih plinova. Drugim riječima, ugljični dioksid nije otrovna tvar, ali može značajno utjecati na protok kisika u tijelo. Kada se razina ugljičnog dioksida poveća na 3-4%, osoba postaje ozbiljno slaba i počinje spavati. Kada se razina poveća na 10%, počinju se razvijati jake glavobolje, vrtoglavica, oštećenje sluha, a ponekad dolazi i do gubitka svijesti. Ako se koncentracija ugljičnog dioksida podigne na razinu od 20%, tada dolazi do smrti od kisikovog izgladnjivanja.
Liječenje trovanja ugljičnim dioksidom je vrlo jednostavno - dati žrtvi pristup čistom zraku, ako je potrebno, za umjetno disanje. U ekstremnim slučajevima, žrtvu morate povezati s ventilatorom.
Iz opisa utjecaja ova dva ugljikova oksida na tijelo možemo zaključiti da ugljični monoksid, s visokom toksičnošću i usmjerenim djelovanjem na tijelo iznutra, još uvijek predstavlja veliku opasnost za ljude.
Ugljični dioksid se ne razlikuje u takvoj izdaji i manje je štetan za ljude, stoga je ta tvar osoba koja ga koristi čak iu prehrambenoj industriji.
Korištenje ugljikovih oksida u industriji i njihov utjecaj na različite aspekte života
Ugljikovi oksidi se vrlo široko koriste u raznim poljima. ljudske aktivnosti i njihov raspon je izuzetno bogat. Dakle, ugljični monoksid se upotrebljava snažno i glavno u metalurgiji u procesu taljenja željeza. CO je stekao široku popularnost kao materijal za skladištenje hrane u ohlađenom stanju. Ovaj oksid se koristi za preradu mesa i ribe kako bi im dao svjež izgled i ne mijenjaju okus. Važno je ne zaboraviti na toksičnost ovog plina i zapamtiti da dopuštena doza ne smije prelaziti 200 mg na 1 kg proizvoda. CO se nedavno u automobilskoj industriji sve više koristi kao gorivo za automobile na plin. 
Ugljični dioksid nije toksičan, tako da se njegov opseg primjene široko primjenjuje u prehrambenoj industriji, gdje se koristi kao konzervans ili prašak za pecivo. CO 2 se također koristi u proizvodnji mineralne i gazirane vode. U čvrstom stanju ("suhi led") često se koristi u postrojenjima za zamrzavanje kako bi se održala stabilna niska temperatura u prostoriji ili uređaju.
Ugljični dioksidni aparati za gašenje požara postali su vrlo popularni, a pjena koja potpuno izolira vatru od kisika i ne dopušta rasplamsavanje vatre. Prema tome, druga primjena je sigurnost od požara. Cilindri u pneumatskim pištoljima također su napunjeni ugljičnim dioksidom. I naravno, gotovo svatko od nas čita od čega se sastoji osvježivač zraka. Da, jedna od komponenti je ugljični dioksid.
Kao što vidimo, zbog svoje minimalne toksičnosti, ugljični dioksid je sve češći u svakodnevnom životu osobe, dok je ugljični monoksid našao primjenu u teškoj industriji.
Postoje i drugi spojevi ugljika s kisikom, a korist formule ugljika i kisika omogućuje korištenje različitih varijanti spojeva s različitim brojem ugljikovih atoma i kisika. Broj oksida može varirati od C2O2 do C32O8 . Da biste opisali svaku od njih, trebat će vam više od jedne stranice.
Ogljikovi oksidi u prirodi
Obje vrste ugljikovih oksida koje se ovdje razmatraju su nekako prisutne u prirodnom svijetu. Dakle, ugljični monoksid može biti proizvod izgaranja šuma ili rezultat ljudske aktivnosti (ispušni plinovi i opasni otpad industrijskih poduzeća).
Već poznati ugljični dioksid također je dio složenog sastava zraka. Sadržaj je oko 0,03% od ukupnog broja. Povećanjem ovog pokazatelja javlja se tzv. Efekt staklenika, od kojeg se moderni znanstvenici toliko boji.  Ugljični dioksid emitiraju životinje i ljudi preko izdisaja. To je glavni izvor takvog korisnog elementa za biljke kao ugljik, zbog čega mnogi znanstvenici žure na to mjesto, ukazujući na nedopustivost velike sječe. Ako biljke prestanu apsorbirati ugljični dioksid, postotak njegovog sadržaja u zraku može doseći kritične vrijednosti za pokazatelje ljudske aktivnosti.
Ugljični dioksid emitiraju životinje i ljudi preko izdisaja. To je glavni izvor takvog korisnog elementa za biljke kao ugljik, zbog čega mnogi znanstvenici žure na to mjesto, ukazujući na nedopustivost velike sječe. Ako biljke prestanu apsorbirati ugljični dioksid, postotak njegovog sadržaja u zraku može doseći kritične vrijednosti za pokazatelje ljudske aktivnosti.
Čini se da su mnogi autoriteti zaboravili materijal iz udžbenika “Opća kemija. 8. stupanj, inače bi problem krčenja šuma u mnogim dijelovima svijeta bio posvećen ozbiljnijoj pozornosti. To se, uzgred, odnosi i na problem prisutnosti ugljičnog monoksida u okolišu. Količina ljudskog otpada i postotak emisija ovog ekstremno toksičnog materijala u okoliš povećava se iz dana u dan. I nije činjenica da se sudbina svijeta, opisana u prekrasnom crtiću "Wally", kada je čovječanstvo moralo ostaviti Zemlju zakopano do temelja i otići u druge svjetove u potrazi za boljim životom, neće ponoviti.