Magnezijev hidroksid: opis tvari, svojstava i uporabe
Magnezijev hidroksid je anorganska tvar, to je slabo topljiv spoj, koji uzrokuje stvaranje taloga u vodenim otopinama. Formula magnezijevog hidroksida je Mg (OH) 2 , to jest dvo-kiselinska baza. Topljiviji u vodi od tipičnih netopljivih baza, ali manje topljiv od kalcijevog hidroksida. Zbog toga se naziva slabo topljivim spojevima.
Raširiti u prirodi
Magnezijev hidroksid u prirodi nalazi se u obliku mineralnog brucita. Velike naslage ove pasmine su vrlo rijetke. U Rusiji se kopa na nalazištu Kuldur, gdje se njegove rezerve procjenjuju na 14 milijuna tona. Proizvodnja na njoj ide brzinom od oko 250 tisuća tona proizvoda godišnje, ali se od ove godine obujam proizvodnje udvostručio. Razlog tome je dobra potražnja za ovim mineralom u inozemstvu. Najveći uvoznik je Japan.

Izgledi kao modri bijeli, sivi ili zelenkasto-bijeli kristali sa staklenim bljeskovima na prekidu. Ima prilično nisku tvrdoću pa je lako rezati nožem. Može sadržavati nečistoće. Ovisno o broju i vrsti, izdvajaju se nekoliko podvrsta ovog minerala. Tako ferronemalit sadrži, osim magnezijevog hidroksida, 5% željeza u obliku oksida, a ferobrusit - već čak 36%. Željezni oksid ima smeđu boju (boja hrđe), pa ti minerali dobivaju istu nijansu umjesto uobičajenog svijetlozelenog. Tu je i mangobrusite. Ovdje je nečistoća mangan. Ovaj mineral ima medo-žutu boju. No, nakon kontakta s kisikom iz zraka, mineral brzo gubi svoju lijepu boju i brzo pocrni.
Nanesite ovaj mineral uglavnom kao sirovine. Proizvodi okside i druge magnezijeve spojeve, fluksove i razne vatrostalne materijale. Ali brucit se može primijeniti bez ikakve obrade. Dakle, ovaj mineral se koristi za pročišćavanje plinova iz klora i za sorpcijsku filtraciju vode.
recepcija
Glavna reakcija za dobivanje netopljivih hidroksida je reakcija interakcije alkalija s magnezijevim solima. Na primjer, u interakciji magnezijevog sulfata s natrijevim hidroksidom. Ovo je dobra ilustracija. I još jedan primjer - u interakciji magnezijevog klorida i kalijevog hidroksida.
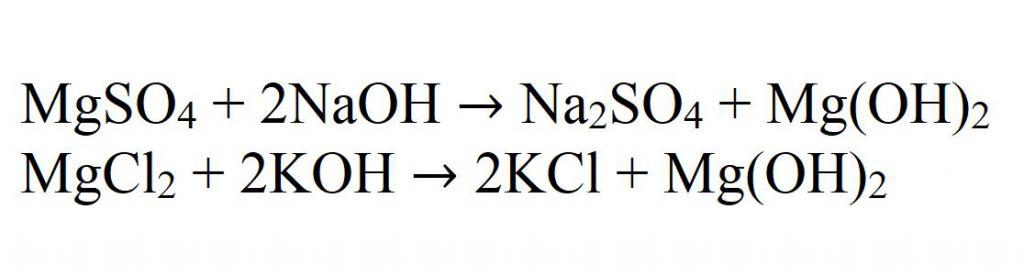
U ionskom obliku sve takve reakcije su napisane kao:
Mg 2+ + OH - → Mg (OH) 2
Interakcija magnezija ili njegovog oksida s vodom također može proizvesti hidroksid. Ova reakcija je vrlo spora i samo kad se zagrijava.
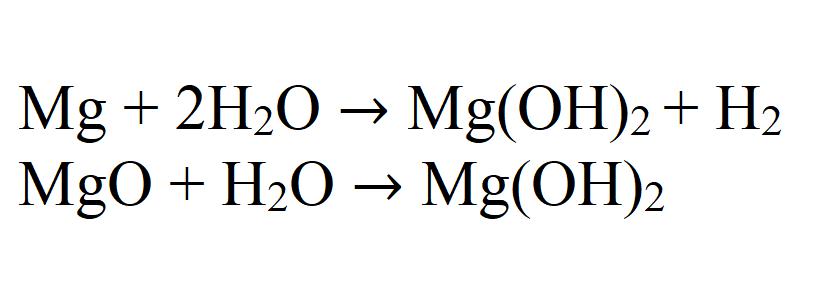
Takav je relativno čest mineral - dolomit. S kemijske točke gledišta, to je mješavina kalcijevog karbonata i magnezija. Pri obradi ovog minerala vodenom otopinom magnezijevog klorida, kada se zagrijava, taloži se netopljivi hidroksid:
MgCO3CaC03 + 2H2O + MgCl2 → Mg (OH) 2 + CaCl2 + 2C02
Fizička svojstva
U suhom obliku, magnezijev hidroksid je bijela kristalna supstanca. Ne miriše, ali ima alkalni okus. Slabo je topljiv u vodi (samo 0,6 mg na 100 ml vode). No čak i unatoč tome, njegove vodene otopine imaju slab alkalni medij i boje odgovarajućih boja. Ali ovaj spoj se otopi u otopinama amonijevih soli. Ne topi se, jer se na temperaturi od 480 o C razgrađuje na magnezijevom oksidu i vodi, kao i svaka druga netopljiva baza. Gustoća pod normalnim uvjetima: 2,4 g / cm3.
Kemijska svojstva
Magnezijev hidroksid je tipična netopljiva baza. To određuje njegova kemijska svojstva. Na primjer, magnezijev hidroksid reagira s kiselinama, kiselim oksidima i nemetalima:
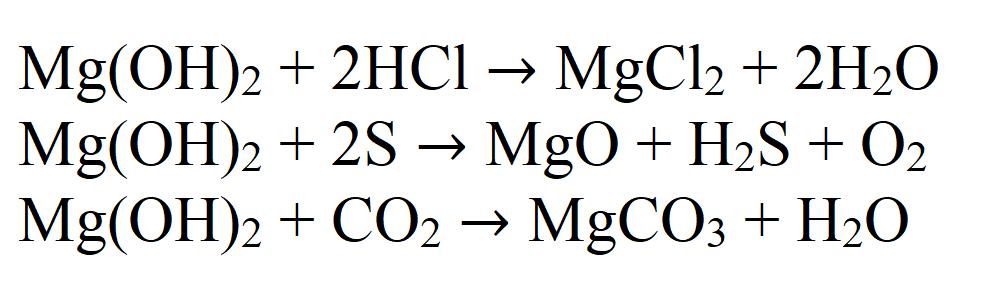
Zbog potonje reakcije nastoji apsorbirati ugljični dioksid izravno iz zraka da bi se stvorio karbonat, stoga se ne preporučuje da se ova tvar dugo drži otvorenom.
Također reagira s solima, ako reakcija proizvodi talog ili plin:

Kao što je gore spomenuto, kada se zagrije, magnezij hidroksid se raspada prema jednadžbi:
Mg (OH) 2 → H20 + MgO
Što se tiče stvaranja kompleksnih spojeva, gdje bi magnezij kation djelovao kao ligand, postoje suprotne informacije o ovoj točki. Neki izvori ukazuju da magnezij nije sklon njihovom stvaranju, a postoje samo nestabilni spojevi s magnezij halidima. Drugi izvori ukazuju da magnezijev hidroksid može reagirati s vrućim alkalijama u obliku hidromagnezata:
Mg (OH) 2 + 2NaOH → Na2 [Mg (OH) 4 ]
Medicinske primjene
U medicini se suspenzije na bazi magnezijevog hidroksida koriste kao antacid. To je olakšano osnovnim svojstvima. Jednom u želucu, magnezijev hidroksid smanjuje kiselost neutraliziranjem klorovodične kiseline. Koristi se za gastritis, čir na želucu i čir na dvanaesniku. Lijekovi na temelju njega ne smanjuju kiselinsko-baznu ravnotežu i ne narušavaju izlučivanje klorovodične kiseline. No, čak i unatoč tome, lijek ima brojna ograničenja i kontraindiciran je za osobe s preosjetljivošću na magnezijev hidroksid.
Produkt interakcije magnezijevog hidroksida i klorovodične kiseline želučanog soka je magnezijev klorid. To je snažan laksativ (djelovanje se odvija nakon 2-6 sati). Stoga je magnezijev hidroksid aktivna komponenta nekih lijekova na ovom području. Višak magnezija u tijelu lako se izlučuje putem bubrega, ali ako osoba pati od bilo kakvih bolesti ovih organa, tada može dobiti višak magnezija u tijelu kada uzima lijekove (hiper-magnezija).
Još jedno svojstvo ovog spoja je opuštanje mišića. Ponekad se preparati koji sadrže magnezijev hidroksid prepisuju ženama s prijetnjom pobačaja.
Primjena u drugim industrijama
Magnezij hidroksid se koristi u prehrambenoj industriji kao aditiv E528. U proizvodima regulira kiselost i stabilizira boju. Magnezijev hidroksid se također koristi za vezanje sumpornog dioksida, čiji je izgled nepoželjan u prehrambenim proizvodima. Koristi se u proizvodnji konzerviranog povrća, umaka, krastavaca i sira. Ovaj dodatak se smatra bezopasnim, ali je zabranjen u Australiji, Velikoj Britaniji i Novom Zelandu.
Također, magnezij hidroksid se koristi kao dodatak za usporavanje plamena u polimerima (PVC, poliolefini), kao aditiv u deterdžentima i zubnim pastama, za rafiniranje šećera i obradu otpadnih voda.
Oksid dobiven iz magnezijevog hidroksida je vrlo koristan spoj. Sposoban je izdržati temperature od oko 3000 stupnjeva, pa se koristi kao vatrostalna. Dakle, ona se dodaje opekama, od kojih zatim prave visoke peći. Upotrijebiti magnezijev oksid i kao sorbent za pročišćavanje naftnih produkata. Abrazivna sposobnost ovog spoja je također visoka. Čisti i polira površine dijelova u elektroničkoj industriji.