Vrste kemijskih reakcija. Klasifikacija kemijskih reakcija
Pojam o tome koje su vrste kemijskih reakcija neraskidivo je povezan s osnovnim znanjem o predmetu, koje se nužno podučava u školi. Za razliku od fizičke metamorfoze, u kemiji postoji transformacija tvari iz jedne ili više u drugu ili nekoliko drugih. Na tome se temelje gotovo sve vrste kemijskih reakcija.
Čimbenici kemijske reakcije
Do danas je identificirano dovoljno velik broj reakcija koje na ovaj ili onaj način pripadaju području kemije i fizike. Međutim, klasifikacija kemijskih reakcija je takva da ih se može procjenjivati prema nekim osnovnim značajkama. Najčešće su to znakovi vizualne prirode.

Na primjer, najlakši način da se utvrdi je li došlo do kemijske reakcije ili ne, jest promjena boje tvari ili otopine, taloženja, razvitka plina itd. Sve to nije teško primijetiti, kako kažu, čak i oko. U nekim slučajevima ova metoda ne radi. To se posebno odnosi na tekuće reagense kao što su kiseline i lužine kada se otopi u vodi. Iako je taj proces isključivo povezan s fizikalnim procesima, ipak se hidratacija ili hidroliza razmatra upravo sa stajališta znanosti kao što je kemija. Kemijske reakcije određuje se dodatnim sredstvima. Na primjer, ako odredite pH otopine, ovdje nećete vidjeti ništa vizualno. Rješenja se koriste za označavanje lakmus papir koja je obojena u određenoj boji, ovisno o kiselosti medija.

Međutim, definicija nije ograničena samo na vizualne efekte. To mogu potvrditi i drugi ne manje zamjetni čimbenici koji se pojavljuju tijekom ili završetka procesa. A ima ih dosta.
Jednako je zanimljiva značajka povećanje temperature ili požar u spoju. Dovoljno je podsjetiti se na školska iskustva kada se komad kalija baci u vodu, nakon čega se oslobađa vodik. Ako uzmete dovoljno velik komad ovog metala i pravu količinu vode, možete čak postići činjenicu da će se dogoditi eksplozija nevjerojatne sile. Imajte na umu da takvi slučajevi u povijesti, nažalost, nisu jedinstveni.

Glavni tipovi kemijskih reakcija
Što se tiče vrsta kemijskih reakcija koje se mogu razlikovati na sadašnjem stupnju razvoja kemije, ovdje se na početku može spomenuti da se procesi mogu inicijalno i uvjetno podijeliti na homogene i heterogene. Homogeni procesi odvijaju se u istoj fazi (recimo, tekuće), a heterogene reakcije koriste nekoliko stanja tvari (tekuće, kruto, plinovito, itd.) Kao glavne reaktante.
Ali takva podjela na tipove kemijskih procesa daleko je od jedinstvenog, jer je ovdje potrebno točno uzeti u obzir pretvorbu tvari koje sudjeluju u reakciji iz jedne u drugu.
Isti alkemičari pokušali su jednom dobiti zlato iz olova. Zapravo, taj se proces može pripisati kemiji prilično neizravno.

Zapravo, transformacija jednog elementa u drugi pripada, prije, području nuklearne fizike. Danas je moguće proizvesti takav proces, međutim, zlato dobiveno na taj način postaje vrlo visoko radioaktivno, nevjerojatno skupo i jednostavno je neprikladno za upotrebu.
Međutim, u osnovnom razumijevanju podjele na klase kemijskih reakcija treba razlikovati najčešće vrste. U osnovi su uzeti četiri glavne klase: reakcija spoja, razgradnja, supstitucija i ionska izmjena. Postoji i peti tip, koji se u svojoj biti ne uklapa ni u jednu od gore navedenih klasa. Radi se o redoks reakcijama, u kojima, u pravilu, kalijev permanganat (KMnO 4 ) djeluje kao glavni reagens, koji se, zajedno s kiselinama, smatra jednim od najmoćnijih oksidacijskih sredstava poznatih čovječanstvu.

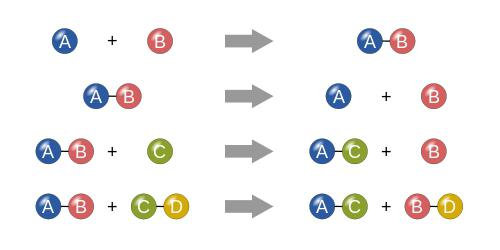
Reakcije spojeva
Ako govorimo o uvjetima kemijskih reakcija ovog tipa, uvjetno, sam proces može biti predstavljen kao neka vrsta matematičkog izraza. Pretpostavimo da imamo dvije tvari. Uobičajeno, označavamo ih kao “A” i “B”. U tom slučaju, reakcija će imati sljedeću formulu:
A + B = AB
Kao što je već jasno, jednostavno postoji fuzija dviju komponenti (bilo da se radi o jednostavnim ili složenim tvarima, koje su spojevi).
Najjednostavniji primjer je stvaranje oksida. Na primjer:
S + O2 = S02
Reakcije razgradnje
Zapravo, klasifikacija kemijskih reakcija je nemoguća bez razumijevanja procesa razgradnje. Na temelju gore navedenog primjera, sam proces može biti predstavljen kao formula:
X = AB - A - B ,
gdje je AB početna supstanca, a A i B su sastojci u kojima će se razgraditi. Prema tome, X je rezultat, koji predstavlja dvije komponente A i B, koje na kraju reakcije ne reagiraju jedna s drugom.
Reakcije zamjene
Uvjeti kemijskih reakcija s supstitucijom također imaju svoje karakteristike. Na temelju jednostavne matematike, ovaj tip procesa može se opisati sljedećim primjerom:
Pretpostavimo da imamo određeni spoj u obliku dvije komponente “AB” i određenu tvar “C”. U tom pogledu, reakcija supstitucije bit će:
AB + C = AC + B ili AB + C = BC + A.
Drugim riječima, javlja se uobičajena zamjena jedne ili više komponenti za drugu.
Reakcije ionske izmjene
Brzinu kemijske reakcije najbolje ilustrira primjer reakcije ionske izmjene, kada se reaktanti izmjenjuju s ionima (nabijenim česticama). U ovom slučaju može biti maksimalno, budući da se pretvorba jedne tvari u drugu događa na molekularnoj razini. U matematičkom izrazu, ova formula ima oblik:
AB + CD = AD + CB (ili u drugim varijacijama).
U biti, reakcije ionske izmjene donekle su slične reakcijama supstitucije, iako pripadaju zasebnoj klasi.
Redoks reakcije
Što se tiče reakcija ovog tipa, one su među svim poznatim najsloženijim (da ne spominjemo reakcije sinteze). Činjenica je da čak i izrada uobičajene kemijske jednadžbe koja uključuje kalijev permanganat bez posebnog znanja jednostavno neće raditi. Ovdje je potrebno uzeti u obzir ne samo valenciju svake početne komponente, nego i valenciju koju komponente dobivaju nakon završetka procesa. U većini slučajeva valencija može varirati unutar prilično širokih granica, a rezultat reakcije dviju početnih komponenti može biti stvaranje tri ili četiri spoja.
Čimbenici koji utječu na brzinu kemijskih reakcija
Brzina same kemijske reakcije ovisi o sposobnosti reaktanata da uđu u proces, kao i od nekih dodatnih uvjeta, kao što je temperatura. Najjednostavniji primjer je upotreba katalizatora - tvari koja može ubrzati kemijsku reakciju. Na primjer, da bi se to usporilo u nekim slučajevima, mogu se koristiti tvari kao što su inhibitori, adsorbenti, apsorbenti itd. Svaka takva tvar može imati značajan utjecaj na cijeli kemijski proces i njegovu brzinu protoka.
Među supstancama ovog tipa, obična osoba je upoznata s aktivnim ugljenom, koji može apsorbirati kiseline ili baze, ovisno o okolini u kojoj se nalazi.

zaključak
Kao što možete vidjeti, vrste kemijskih reakcija za običnu osobu razumjeti su vrlo jednostavne. Najvažnija stvar u ovom pitanju je jasno razjasniti što je proces. Primijetite, u ovom slučaju, razmatrali smo kemijske procese koji se temelje na jednostavnoj matematici, bez ulaženja u detalje kemije. Čini se da će ovaj pristup pomoći da se objasni suština glavnih kemijskih procesa, da tako kažemo, "na prstima". Štoviše, sa stajališta matematike svatko će moći razumjeti što određeni proces zapravo jest.
U ovom slučaju ne razmatraju se kemijske reakcije i sustavi u kojima interakcija ima više od dva reaktanta. Da biste ih razumjeli, morate imati određeno znanje. Samo s njima bit će moguće napraviti jednaku jednadžbu koja opisuje taj proces, da ne spominjemo organsku kemiju, gdje će se, da bi se razumjelo što je tvar, čak i morati primijeniti strukturne formule, na primjer, na temelju benzenskog prstena ili vezanih radikala.
U tom slučaju morate se odvojiti od uobičajenih osnova anorganska kemija koji opisuje većinu procesa najjednostavnije i konciznije. To je istina, jer u zoru razvoja same organske znanosti nitko nije imao pojma, međutim, rezultati otkrića i mnoga istraživanja jednostavno zadivljuju.