Kemijsko povezivanje - pojam i klasifikacija
Svaka interakcija između atoma moguća je samo ako postoji kemijska veza. Takva veza uzrokuje stvaranje stabilnog poliatomskog sustava - molekulskog iona, molekule, kristalna rešetka. Snažna kemijska veza zahtijeva puno energije da se slomi, pa je to osnovna količina za mjerenje čvrstoće veze.
Uvjeti kemijskog povezivanja
Formiranje kemijske veze uvijek je praćeno otpuštanjem energije. Taj se proces događa uslijed smanjenja potencijalne energije sustava međudjelujućih čestica - molekula, iona, atoma. Potencijalna energija rezultirajući sustav interakcijskih elemenata je uvijek manji od energije nevezanih izlaznih čestica. Stoga je osnova za nastanak kemijske veze u sustavu smanjenje potencijalne energije njezinih elemenata.
Priroda kemijske interakcije
Kemijsko povezivanje posljedica je interakcije elektromagnetskih polja koja nastaju oko elektrona i atomskih jezgri onih tvari koje sudjeluju u stvaranju nove molekule ili kristala. Nakon otkrića teorije o strukturi atoma, priroda te interakcije postala je pristupačnija za proučavanje. 
Po prvi put, ideja o električnoj prirodi kemijskih veza nastala je u engleskom fizičaru G. Deviju, koji je sugerirao da se molekule formiraju zbog električnog privlačenja suprotno nabijenih čestica. Ova ideja zanimala je švedskog kemičara i prirodoslovca I.Ya. Berzelius, koji je razvio elektrokemijsku teoriju kemijskih veza.
Prva teorija, koja je objasnila procese kemijske interakcije tvari, bila je nesavršena, a vremenom se morala napustiti.
Teorija Butlerova
Uspješniji pokušaj da se objasni priroda kemijske veze tvari proveo je ruski znanstvenik A.M.Butlerov. Na temelju njegove teorije, ovaj je znanstvenik postavio takve pretpostavke:
- Atomi u povezanom stanju su međusobno povezani u određenom redoslijedu. Promjena ovog poretka je uzrok stvaranja nove tvari.
- Atomi su vezani valentnim zakonima.
- Svojstva tvari ovise o redoslijedu atoma spoja u molekuli tvari. Različiti redoslijed lokacija uzrokuje promjenu kemijskih svojstava tvari.
- Atomi povezani međusobno najjače utječu jedni na druge.
Butlerova teorija objašnjava svojstva kemikalija ne samo njihovim sastavom, već i rasporedom atoma. Takav interni poredak A.M. Butlerov je nazvao "kemijskom strukturom". 
Teorija ruskog znanstvenika dopustila je da se stvari svrstavaju u klasifikaciju tvari i pružila mogućnost određivanja strukture molekula prema njihovim kemijskim svojstvima. Teorija je također odgovorila na pitanje: zašto molekule koje sadrže isti broj atoma imaju različita kemijska svojstva?
Preduvjeti za stvaranje teorija kemijskih veza
U svojoj teoriji kemijske strukture, Butlerov nije dotaknuo pitanje što je to kemijska veza. Za to je tada bilo premalo podataka o unutarnjoj strukturi tvari. Tek nakon otvaranja planetarni model atoma Američki znanstvenik Lewis počeo je razvijati hipotezu da kemijska veza nastaje stvaranjem elektronskog para, koji istovremeno pripada dva atoma. Potom je ova ideja postala temelj za razvoj teorije kovalentnih veza.
Kovalentna kemijska veza
Stabilan kemijski spoj može nastati kada se elektronski oblaci dvaju susjednih atoma preklapaju. Rezultat tog međusobnog sjecišta je povećana gustoća elektrona u internuklearnom prostoru. Jezgre atoma, kao što je dobro poznato, su pozitivno nabijene i stoga se pokušavaju izvući što bliže negativno nabijenom elektronskom oblaku. Ta je privlačnost mnogo jača od odbojne sile između dvije pozitivno nabijene jezgre, pa je taj odnos stabilan.
Po prvi put kalkulacije kemijske veze proveli su kemičari Geytler i London. Razmotrili su vezu između dva atoma vodika. Najjednostavniji vizualni prikaz može izgledati ovako: 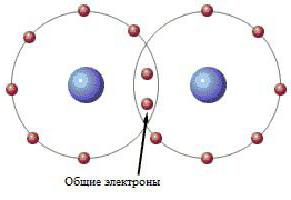
Kao što se može vidjeti, elektronski par zauzima kvantno mjesto u oba atoma vodika. Ovo dvo-središnje postavljanje elektrona naziva se kovalentna kemijska veza. Kovalentna veza tipične za molekule jednostavnih tvari i njihovih spojeva nemetala. Tvari koje nastaju kao rezultat kovalentnog vezanja obično ne provode električnu struju ili su poluvodiči.
Jonska veza
U slučaju međusobnog električnog privlačenja dva suprotno nabijena iona javlja se kemijska veza ionskog tipa. Ioni mogu biti jednostavni, a sastoje se od jednog atoma tvari. U spojevima ovog tipa, jednostavni ioni su najčešće pozitivno nabijeni atomi metala u skupinama 1, 2 koji su izgubili svoj elektron. Formiranje negativnih iona inherentno je atomima tipičnih nemetala i bazama njihovih kiselina. Stoga, među tipičnim ionskim spojevima postoji mnogo halogenida alkalijskih metala na primjer CsF, NaCl i drugi. 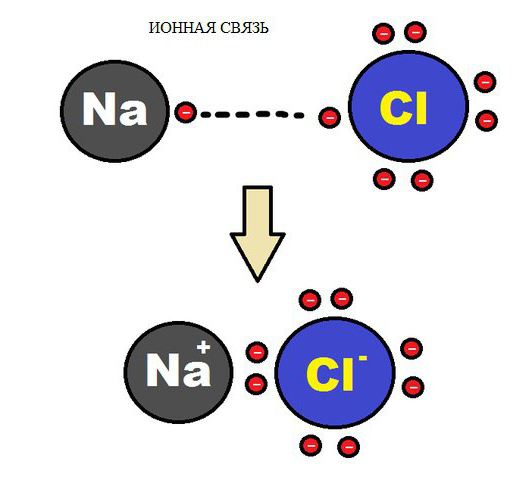
Za razliku od kovalentne veze, ion nije zasićen: različit broj suprotno nabijenih iona može se pridružiti ionu ili skupini iona. Broj vezanih čestica ograničen je samo linearnim dimenzijama interakcijskih iona, kao i uvjetom pod kojim atraktivne sile suprotno nabijenih iona moraju biti veće od odbojnih sila jednako nabijenih čestica koje sudjeluju u ionskom spoju.
Vodikova veza
Čak i prije stvaranja teorije kemijske strukture, eksperimentalno je uočeno da vodikovi spojevi s različitim nemetalima posjeduju nešto neobična svojstva. Na primjer, točka ključanja vodikovog fluorida i vode je mnogo veća od očekivane. 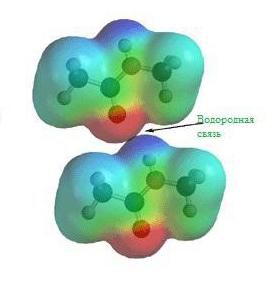
Te i druge značajke vodikovih spojeva mogu se objasniti sposobnošću H + atoma da formira drugu kemijsku vezu. Ova vrsta spoja naziva se "vodikova veza". Uzroci vodikove veze ukorijenjeni su u svojstvima elektrostatskih sila. Na primjer, u molekuli vodikovog fluorida, obični elektronski oblak je tako pomaknut prema fluoru, da je prostor oko atoma ove tvari zasićen negativnim električnim poljem. Oko vodikovog atoma, bez svog jedinog elektrona, polje je mnogo slabije i ima pozitivan naboj. Kao rezultat toga, pojavljuje se dodatni odnos između pozitivnih polja oblaka elektrona H + i negativnog F - .
Kemijska veza metala
Atomi svih metala nalaze se u prostoru na određeni način. Raspored atoma metala naziva se kristalna rešetka. U ovom slučaju, elektroni različitih atoma slabo međusobno djeluju, tvoreći obični elektronski oblak. Ova vrsta interakcije između atoma i elektrona naziva se "metalna veza". 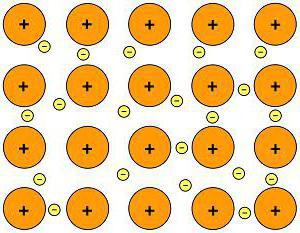 Slobodno kretanje elektrona u metalima može objasniti fizikalna svojstva metalnih tvari: električnu vodljivost, toplinsku vodljivost, čvrstoću, topljivost i druge.
Slobodno kretanje elektrona u metalima može objasniti fizikalna svojstva metalnih tvari: električnu vodljivost, toplinsku vodljivost, čvrstoću, topljivost i druge.