Radioaktivni kemijski element. Umjetni radioaktivni element
Do kraja XIX. Stoljeća svi kemijski elementi izgledali su trajno i nedjeljivo. Nije bilo pitanja o tome kako pretvoriti nepromjenjive elemente. No otkriće radioaktivnosti promijenilo je svijet koji je nama poznat i otvorio put otkrivanju novih tvari.
Otkriće radioaktivnosti
Čast otkrića transformacije elemenata pripada francuskom fizičaru Antoineu Becquerelu. Za jednu kemijsko iskustvo Trebali su mu kristali uranil kalij sulfat. Omotao je tvar u crni papir i stavio torbu blizu fotografske ploče. Nakon što je razvio film, znanstvenik je na slici vidio obrise kristala uranila. Unatoč debelom sloju papira, jasno su se razlikovali. Becquerel je ponovio ovaj pokus nekoliko puta, ali rezultat je bio isti: obrisi kristala koji sadrže uran su bili jasno vidljivi na fotografskim pločama.
Rezultati otkrića Becquerela najavili su na sljedećem sastanku, koji je održala Pariška akademija znanosti. Njegovo je izvješće započelo riječima "nevidljivo zračenje". Tako je opisao rezultate svojih eksperimenata. Nakon toga fizičari su počeli koristiti pojam zračenja.
Curieovi eksperimenti
Rezultati Becquerelovih zapažanja zainteresirali su francuske znanstvenike Marie i Paul Curie. S pravom su smatrali da ne samo da bi uranij mogao imati radioaktivna svojstva. Istraživači su primijetili da su ostaci rude iz kojih se ta supstanca izlučuje i dalje visoko radioaktivni. Pretraživanje elemenata koji se razlikuju od početnih doveli su do otkrića tvari sa svojstvima sličnim uranu. Novi radioaktivni element dobio je ime polonij. Takvo ime Marie Curie dala je tvar u čast svoje domovine - Poljske. Nakon toga, otkriven je radij. Radioaktivni element bio je proizvod raspada čistog urana. Nakon toga, u kemiji je počelo doba novih, koje se prije nisu susrele u prirodi. kemikalije.
elementi
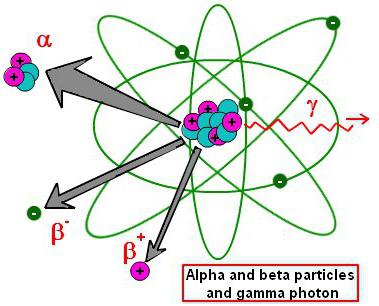
Većina trenutno poznatih jezgri kemijskih elemenata je nestabilna. Vremenom se takvi spojevi spontano razbijaju u druge elemente i razne sitne čestice. Teži roditeljski element u zajednici fizičara naziva se izvornim materijalom. Proizvodi nastali razgradnjom tvari nazivaju se djeca ili proizvodi razgradnje. Sam proces prati oslobađanje različitih radioaktivnih čestica.
izotopi
Nestabilnost kemijskih elemenata može se objasniti postojanjem različitih izotopa iste tvari. Izotopi su varijacije nekih elemenata periodičkog sustava s istim svojstvima, ali s različitim brojem neutrona u jezgri. Mnoge obične kemijske tvari imaju najmanje jedan izotop. Činjenica da su ti elementi široko rasprostranjeni i dobro proučeni potvrđuje da su oni u stabilnom stanju, proizvoljno dugo. Ali svaki od ovih "dugovječnih" elemenata sadrži izotope. Njihovi znanstvenici proizvode jezgre tijekom laboratorijskih reakcija. Umjetni radioaktivni element proizveden sintetičkim sredstvima ne može dugo postojati u stabilnom stanju i raspada se tijekom vremena. Ovaj proces može ići na tri načina. Po imenu elementarnih čestica, koje su nusproizvodi termonuklearne reakcije, sve tri vrste propadanja dobile su svoja imena.
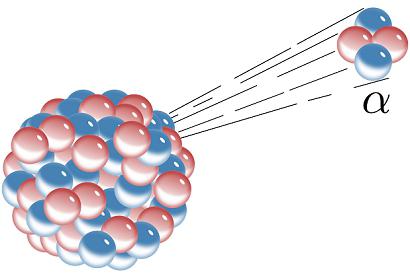
Alfa raspad
Radioaktivni kemijski element može se transformirati prema prvoj shemi raspada. U ovom slučaju, iz jezgre se izbacuje alfa čestica čija energija doseže 6 milijuna eV. Detaljno proučavanje rezultata reakcije pokazalo je da je ta čestica atom helija. Izvlači dva protona iz jezgre, tako da će rezultirajući radioaktivni element imati atomski broj u periodičnom sustavu dva položaja niža od onog od matične tvari.
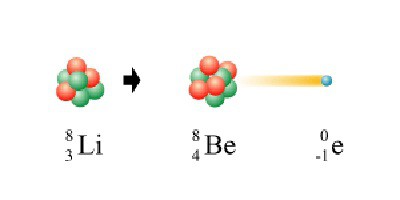
Beta propadanje
Reakciju beta raspadanja prati emisija jednog elektrona iz jezgre. Pojava ove čestice u atomu povezana je s raspadom neurona u elektron, proton i neutrino. Kako elektron odlazi iz jezgre, radioaktivni kemijski element povećava svoj atomski broj za jednu jedinicu i postaje teži od svog roditelja.
Gama raspad
S raspadom gama, jezgra emitira fotonski zrak s različitim energijama. Ove zrake se nazivaju gama zračenje. U tom procesu radioaktivni element nije modificiran. Samo gubi energiju.
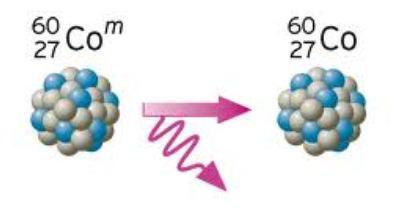
Sama po sebi, nestabilnost koju posjeduje radioaktivni element uopće ne znači da s određenom količinom izotopa naša tvar iznenada nestaje, oslobađajući ogromnu energiju. U stvarnosti, raspad jezgre podsjeća na kuhanje kokica - kaotično kretanje zrna kukuruza u tavi i potpuno je nepoznato koji će od njih biti prvi otkriven. Zakon radioaktivne reakcije raspadanja može jamčiti samo da će u određenom vremenskom razdoblju broj čestica, proporcionalan broju preostalih nukleona u jezgri, izletjeti iz jezgre. U jeziku matematike taj se proces može opisati sljedećom formulom:
dN = λNdt.
Ovdje, na licu je proporcionalna ovisnost broja nuklona dN koji napuštaju jezgru tijekom perioda dt, od broja svih nukleona prisutnih u nukleusu N. Koeficijent λ je konstanta radioaktivnosti razgradnje tvari.
Broj nukleona koji ostaju u jezgri u vremenu t opisan je formulom:
N = N 0 e –tl ,
u kojoj je N 0 broj nukleona u jezgri na početku promatranja.
Na primjer, radioaktivni element halogen s atomskim brojem 85 otkriven je tek 1940. Njegov poluživot je prilično dug - 7,2 sata. Sadržaj radioaktivnog halogena (astatina) na cijelom planetu ne prelazi jedan gram čiste tvari. Prema tome, za 3,1 sat njegova bi se priroda u teoriji trebala prepoloviti. No konstantni procesi raspadanja urana i torija dovode do stvaranja novih i novih astaminskih atoma, iako u vrlo malim dozama. Stoga njegova količina u prirodi ostaje stabilna.
Pola života
Konstanta radioaktivnosti služi kako bi se pomoću nje utvrdila kako će se brzo propadati elemenat koji se istražuje. Ali za praktične probleme, fizičari često koriste količinu koja se naziva poluživot. Ovaj pokazatelj govori koliko dugo će tvar izgubiti točno polovicu svojih nukleona. Za različite izotope ovo razdoblje varira od sitnih dijelova sekunde do milijardi godina.
Važno je razumjeti da se vrijeme u ovoj jednadžbi ne zbraja, već se množi. Primjerice, ako tijekom vremena t tvar izgubi polovicu svojih nukleona, tada će tijekom razdoblja od 2t izgubiti još polovicu ostatka - tj. Jednu četvrtinu izvornog broja nukleona.
Pojava radioaktivnih elemenata
Naravno, radioaktivne tvari nastaju u gornjoj atmosferi Zemlje, u ionosferi. Pod djelovanjem kozmičkog zračenja, plin na visokoj nadmorskoj visini prolazi kroz različite promjene koje pretvaraju stabilnu tvar u radioaktivni element. Najčešći plin u našoj atmosferi je N2, na primjer, iz stabilnog izotopa, dušik-14 se pretvara u radioaktivni izotop ugljika-14.
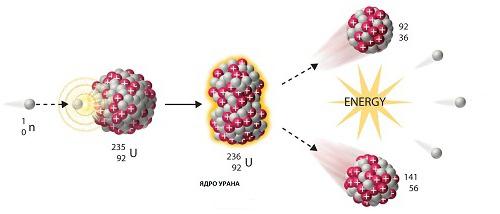
Danas se mnogo češće javlja radioaktivni element u lancu umjetnih reakcija atomske fisije. To je naziv procesa u kojem se jezgra roditeljske tvari dijeli na dvije podružnice, a zatim na četiri radioaktivna unuka. Klasičan primjer je izotop urana 238. Njegov poluživot iznosi 4,5 milijardi godina. Gotovo isto toliko naših planeta postoji. Nakon deset stupnjeva propadanja, radioaktivni uranij se pretvara u stabilnu olovo 206. Umjetno dobiveni radioaktivni element se ne razlikuje po svojim svojstvima od prirodnog.
Praktični značaj radioaktivnosti
Nakon katastrofe u Černobilu, mnogi su ozbiljno razgovarali o ograničavanju razvojnih programa. nuklearne elektrane. No, u domaćem smislu, radioaktivnost donosi ogromnu korist čovječanstvu. Proučavanje mogućnosti njegove praktične primjene bavi se znanošću radiografije. Na primjer, radioaktivni fosfor se daje pacijentu kako bi se dobila potpuna slika fraktura kostiju. Nuklearna energija također služi za proizvodnju topline i električne energije. Možda u budućnosti čekamo nova otkrića u ovom nevjerojatnom području znanosti.