Što je elektroliza u kemiji?
Prvo, pokušajmo razumjeti što je elektroliza. To su kemijske reakcije koje se odvijaju pod utjecajem električne struje na elektrodama, koje se stavljaju u otopinu taline ili elektrolita.
Neki teorijski koncepti
Elektrolit je tvar koja provodi električnu energiju. Elektrode su dvije vrste. Katoda je negativno nabijena elektroda, na njoj se odvija redukcijska reakcija.
Anoda se naziva pozitivno nabijena elektroda, gdje se obavlja restauracija.
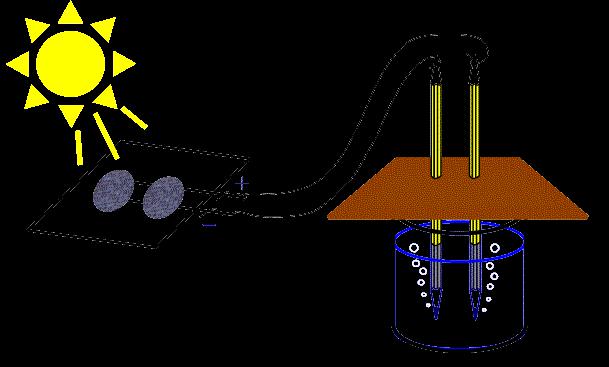
Korištenje procesa
Elektroliza otopina koristi se u raznim granama moderne industrije. U kemijskoj industriji dobiva se klor, lužine, perklorat, klorat, persulfat, organska tvar, kalijev permanganat, persulfurna kiselina, fluor, kisik, vodik i drugi vrijedni proizvodi.
U obojenoj metalurgiji elektroliza talina koristi se za vađenje čistog metala iz ruda. Metali koji se ne mogu izolirati zbog visokog negativnog potencijala iz vodenih otopina dobivaju se u obojenoj metalurgiji elektrolizom talina. Među metalima koji se proizvode elektrolizom takozvanih rastaljenih medija, uočavamo magnezij, aluminij, uranij, berilij, cirkonij.
Elektroliza se koristi u strojarstvu, elektronskoj industriji, radijskom inženjerstvu, tiskanju, kako bi se na proizvode nanosili tanki metalni premazi, štiteći ih od korozije, povećavajući otpornost na habanje, povećavajući otpornost na toplinu.

Povijesna pozadina
Što je elektroliza? To je jedno od najvažnijih područja u elektrokemiji. Znanost je rođena na prijelazu iz 18-19 stoljeća. Tijekom tog razdoblja eksperimente su provodili talijanski fiziolog L. Galvani i fizičar A. Volt. Krajem 18. stoljeća pojavili su se prvi kemijski izvori struje. Početkom 20. stoljeća elektrokemija je počela proučavati elektrokemijske procese. Eksperimentalno je utvrđeno da električna struja koja prolazi kroz vodene otopine soli uzrokuje kemijske transformacije koje dovode do stvaranja novih spojeva.
Raspravljajući o tome što je elektroliza, napominjemo da je riječ o složenom skupu procesa: migracija iona, difuzija, elektrokemijske reakcije ionskog pražnjenja, sekundarne kemijske reakcije produkata elektrolize međusobno.
Klasifikacija procesa
Govoreći o tome što je elektroliza, potrebno je razmotriti klasifikaciju elektrolitičkih procesa. Podijeljeni su na:
- proizvodnja anorganskih spojeva (klor, kisik, vodik);
- stvaranje metala (magnezij, bakar, aluminij, kalij, natrij, berilij, srebro, bakar);
- dobivanje metalnih i galvanskih premaza;
- nitriranje, električno poliranje, boroizacija metalne površine;
- nanošenje filma elektroforezom;
- desalinizacija vode i elektrodijaliza;
- proizvodnju različitih organskih tvari.
Pokusi elektrolize
Kako napraviti jednadžbu elektrolize? Taj se proces odvija u elektrolitima. S dvije ugljične elektrode moguće je spojiti žice koje dolaze iz mreže rasvjete.
U jednom od njih uključite električnu lampu, koja će potvrditi prisutnost u krugu električne struje. Slobodni krajevi elektroda mogu se staviti u suhu kuhinjsku sol ili bezvodnu sumpornu kiselinu.
Svjetiljka ne gori jer tvari ne mogu provoditi električnu struju, a krug ostaje otvoren. Sličan rezultat je uočen u slučaju kada su elektrode uronjene u čašu s destiliranom vodom.
Kada se u vodi otopi mala količina soli, lužine i kiseline, uočava se svijetla luminescencija.
Kada se elektrode spuste u otopinu glicerina ili šećera, svjetiljka također prestane sjati.
Ovaj eksperiment, naravno, potvrđuje provodljivost soli, baza, kiselih otopina električne struje.
Prolaskom električne struje kroz otopine ili taline, uočavaju se kemijske promjene koje se izražavaju u oslobađanju produkata raspadanja otapala ili otopljene tvari.

Što je proces u slučaju kuhinjske soli
Tijekom eksperimentalnih promatranja, primijećeno je da elektroliza vodene otopine natrijevog klorida dovodi do stvaranja vodika na katodi, oslobađanja plinovitog klora na anodi. Kako matematički opisati taj proces? U talini se odvija elektroliza natrijeva klorida, što dovodi do pojave čistog alkalnog metala na katodi i plinovitog klora na anodi.
... i magnezijev klorid
Nakon prolaska eklektičke struje kroz talinu magnezijevog klorida, uočava se pojava magnezijskih kationa i klornih aniona.
Na katodi se uočava redukcija kationa magnezija do čistog metala, klorni anioni, koji odlaze u anodu, doniraju elektrone, odvija se proces oksidacije. Elektroliza magnezijevog klorida može se napisati kao sumarna jednadžba:
MgCl2 = Mg + Cl2
Značajke elektrolize u otopinama
Važno je uzeti u obzir činjenicu da, osim iona elektrolita, u otopini postoje i vodene otopine: kationi vodika i anioni hidroksilne skupine. Zato katoda može ispustiti i elektrolitski kation i vodikov proton. Na anodi se ispuštaju hidroksilni ioni i elektrolitski anioni.

Također, molekule vode mogu biti podvrgnute elektrokemijskoj redukciji ili oksidaciji.
Uz pažljivo razmatranje katodnih procesa koji se javljaju tijekom elektrolize vodene otopine, važno je uzeti u obzir potencijal potencijalnog smanjenja protona vodika. To ovisi o koncentraciji kationa vodika, s vrijednošću od -0, 41 V.
Ako u otopini elektrolita postoji metal, u kojem potencijal elektrode ima pozitivniju vrijednost, katoda će se obnoviti u okviru elektrolize. Ta se tvrdnja odnosi na one metale koji se nalaze u blizini vodika u elektrokemijskom nizu Beketovih naprezanja. Kod negativnije vrijednosti elektrodnog potencijala nego kod kationa vodika, metal se neće oporaviti na katodi. U takvim slučajevima, na toj se elektrodi nakuplja vodik.
Ako je potencijal metala sličan vrijednosti od -0,41 V, dopušteno je istodobno stvaranje vodika i čistog metala na katodi.
Na prirodu postupka katode u slučaju elektrolize otopine soli (lužine) utječe položaj metala u nizu elektrokemijskih napona Beketovih metala.
Pri analizi procesa koji se odvijaju na anodi potrebno je uzeti u obzir činjenicu da je moguća oksidacija anodnog materijala. Zato će elektrokemija odvojiti inertnu anodu, kao i elektrodu koja se sastoji od njihove aktivne anode.
Inert je anoda u kojoj materijal ne prolazi oksidaciju kao dio procesa elektrolize. Aktivno se smatra anodom koja se može oksidirati tijekom elektrolize.
Za inertne anode odaberite platinu, ugljen, grafit. Ova se mogućnost razmatra u školskom tečaju kemije.

Tipični primjeri elektrolize vodenih otopina
Počnimo s osobitostima elektrolize u otopini bakrenog klorida (2). Budući da se taj metal u elektrokemijskom nizu aktivnosti metala nalazi s desne strane vodika, na katodi se formira metalni bakar. Kloridni ioni ispuštaju se u anodni prostor, tvoreći plinoviti klor. Shema procesa prikazana je u sljedećem obliku:
- Katoda: Cu 2+ 2e = Cu.
- Anoda: 2C1-2 - e = Cl2 .
Kumulativna jednadžba:
- CuCl2 = Cu + Cl2 .
Što je elektroliza vodene otopine natrijevog sulfata? Budući da se natrij nalazi u području aktivnosti metala lijevo od vodika, na katodi se promatra formiranje molekularnog vodika. Osim toga, u prostoru katode nakupljaju se hidroksidni ioni.
Na anodi se oslobađa plinoviti kisik i akumuliraju se hidroksidni ioni u blizini te elektrode.
Budući da natrijevi kationi i sulfatni ioni ostaju u otopini, ovaj dio otopine ostaje električno neutralan. Shema takve elektrolize može se prikazati kako slijedi:
- 2Na2S04 + 6H20 = 4NaOH + 2H2S04 + O2 + 2H2

Čimbenici koji utječu na proces elektrolize
Učinkovitost ove kemijske reakcije procjenjuje se s nekoliko čimbenika, među kojima se može primijetiti: napon, struja, trenutna učinkovitost, učinkovitost, potrošnja električne energije po jedinici rezultirajućeg proizvoda, gustoća struje.
Snaga struje karakterizira performanse elektrolita. Što je veća, to je veća količina proizvoda formirana na elektrodama.
Strujni izlaz omogućuje da se uzme u obzir djelotvornost primjene količine električne struje koja prolazi kroz elektrolizer.