Agregatno stanje materije. Promjena stanja materije
Sva materija može postojati u jednoj od četiri vrste. Svaki od njih je određeno agregatno stanje materije. U prirodi Zemlje, samo je jedan zastupljen u tri odjednom. Ovo je voda. Lako je vidjeti i ispariti, otopiti se i očvrsnuti. To jest, para, voda i led. Znanstvenici su naučili mijenjati agregaciju materije. Najveća poteškoća za njih je samo plazma. Ovaj uvjet zahtijeva posebne uvjete.

Što je to, od čega ovisi i kako se ona karakterizira?
Ako se tijelo preselilo u drugo stanje agregacije tvari, to ne znači da se pojavilo nešto drugo. Tvar ostaje ista. Ako je tekućina imala molekule vode, one će biti iste s parom s ledom. Promijenit će se samo njihova lokacija, brzina kretanja i snage međusobne interakcije.
Kod proučavanja teme „Agregatna stanja (8. razred)“, razmatraju se samo tri od njih. Jeste tekući plin i čvrsta. Njihove manifestacije ovise o fizičkim uvjetima okoline. Karakteristike tih stanja prikazane su u tablici.
| Naziv agregiranog stanja | čvrsto tijelo | tekućinu | plina |
| Njegova svojstva | zadržava oblik s volumenom | ima konstantan volumen, ima oblik posude | nema stalan volumen i oblik |
| Raspored molekula | u točkama rešetke | nesređen | haotičan |
| Udaljenost između njih | usporedivo s veličinom molekula | približno jednaka veličini molekula | znatno veća od njihove veličine |
| Kako se kreću molekule | lebdite oko rešetke | ne pomičite se s mjesta ravnoteže, ali ponekad pravite velike skokove | slučajni s povremenim sudarima |
| Kako su u interakciji | jako privlači | snažno privlače jedni druge | ne privlače, odbijajuće sile se javljaju pri udaru |
Prvo stanje: čvrsto
Njegova temeljna razlika u odnosu na druge je ta da molekule imaju strogo određeno mjesto. Kada govore o čvrstom stanju agregacije, često se odnose na kristale. U njima je struktura rešetke simetrična i strogo periodična. Stoga je uvijek sačuvano, koliko daleko tijelo ne bi proširilo. Oscilatorno gibanje molekula tvari nije dovoljno da uništi ovu rešetku.
Ali postoje i amorfna tijela. Nedostaje im striktna struktura rasporeda atoma. Mogu biti bilo gdje. Ali ovo je mjesto stabilno kao u kristalnom tijelu. Razlika između amorfnih i kristalnih tvari je u tome što nemaju određenu točku taljenja (skrućivanje) i za njih je karakteristična protočnost. Živopisni primjeri takvih tvari: staklo i plastika.
Drugo stanje: tekućina
Ovo agregativno stanje materije je križ između krutine i plina. Dakle, kombinira neka svojstva prvog i drugog. Tako je udaljenost između čestica i njihova interakcija slična onoj u kristalima. No mjesto i kretanje bliže plinu. Stoga tekućina ne čuva oblik, već se širi preko posude u koju se uliva.
Treća država: plin
Za znanost nazvanu "fizika" agregatno stanje u obliku plina nije na posljednjem mjestu. Uostalom, ona proučava svijet oko sebe, a zrak u njemu je vrlo čest.
Posebnosti ovog stanja su da su sile interakcije između molekula praktički odsutne. To objašnjava njihovo slobodno kretanje. Zbog toga plinovita tvar ispunjava cijeli volumen koji mu se daje. I u tom stanju možete prenijeti sve, samo trebate povećati temperaturu na željenu vrijednost.
Četvrto stanje: plazma
Ovo agregatno stanje tvari je plin koji je potpuno ili djelomično ioniziran. To znači da je broj negativno i pozitivno nabijenih čestica u njemu gotovo isti. Ova situacija nastaje kada se plin zagrijava. Zatim dolazi do naglog ubrzanja procesa toplinske ionizacije. Leži u činjenici da su molekule podijeljene na atome. Potonji se zatim pretvaraju u ione.

U okviru svemira takvo je stanje vrlo uobičajeno. Zato što sadrži sve zvijezde i okruženje među njima. Unutar granica Zemljine površine, to se događa vrlo rijetko. Osim za ionosferu i solarni vjetar, plazma je moguća samo tijekom oluje. U treptaju munje stvaraju se takvi uvjeti u kojima plinovi atmosfere prelaze u četvrto stanje materije.
Ali to ne znači da se plazma ne stvara u laboratoriju. Prva stvar koja je mogla reproducirati je plinsko pražnjenje. Sada plazma ispunjava fluorescentna svjetla i neonske reklame.

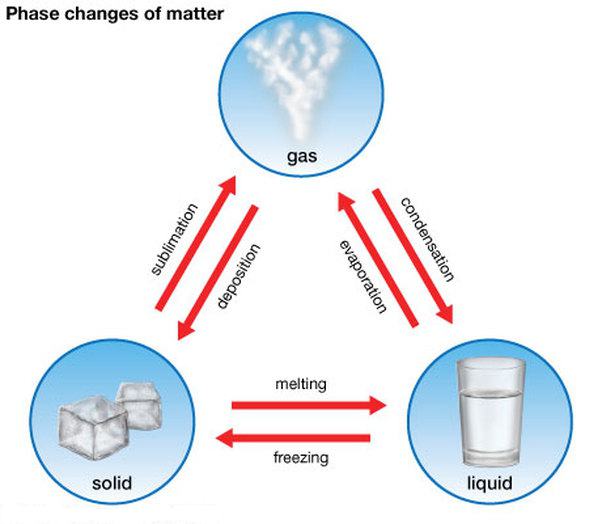
Kako je tranzicija između država?
Da biste to učinili, morate stvoriti određene uvjete: konstantan tlak i određenu temperaturu. U ovom slučaju, promjena agregatnih stanja tvari prati oslobađanje ili apsorpcija energije. Štoviše, taj se prijelaz ne odvija brzinom svjetlosti, ali zahtijeva određenu količinu vremena. Tijekom tog vremena uvjeti moraju biti nepromijenjeni. Prijelaz se odvija istodobnim postojanjem tvari na dva načina, koji održavaju toplinsku ravnotežu.
Prva tri stanja materije mogu ići jedno u drugo. Postoje izravni i obrnuti procesi. Oni imaju sljedeća imena:
- taljenje (od krutog do tekućeg) i kristalizacija , kao što je topljenje leda i otvrdnjavajuće vode;
- isparavanje (od tekućeg do plinovitog) i kondenzacije , primjer je isparavanje vode i njezina proizvodnja iz pare;
- sublimacija (od krutog do plinovitog) i desublimacija , na primjer, isparavanje suhe arome za prvu i mraz na staklu do drugog.
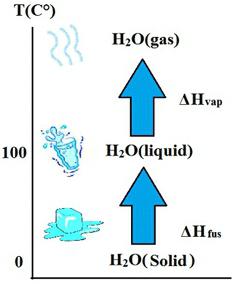
Fizika taljenja i kristalizacije
Ako se krutina zagrije, zatim na određenoj temperaturi, koja se naziva točka topljenja određene tvari, započinje promjena agregatnog stanja, nazvana taljenje. Ovaj proces dolazi s apsorpcijom energije, koja se naziva količina topline i označena je slovom Q. Da biste je izračunali, morate znati specifičnu toplinu fuzije , koja je označena s λ . I formula uzima sljedeći izraz:
Q = λ * m , gdje je m masa tvari koja je uključena u topljenje.
Ako se desi obrnuti proces, tj. Kristalizacija tekućine, uvjeti se ponavljaju. Jedina razlika je u tome što se energija oslobađa i u formuli se pojavljuje znak minus.
Fizika isparavanja i kondenzacije
S nastavkom zagrijavanja tvari postupno će se približavati temperaturi na kojoj će započeti njezino intenzivno isparavanje. Taj se proces naziva isparavanje. Opet je karakterizirana apsorpcijom energije. Samo za njegov izračun potrebno je znati specifičnu toplinu isparavanja r . I formula će biti:
Q = r * m .
Postupak obrnutog kretanja ili kondenzacija pojavljuje se s otpuštanjem istog količine topline. Stoga se u formuli ponovno pojavljuje minus.