Kemijski element je ... Periodni sustav kemijskih elemenata
Kemijski element je kolektivni pojam koji opisuje skup atoma jednostavne tvari, tj. Onaj koji se ne može podijeliti na bilo koje jednostavnije (u strukturi njihovih molekula) komponenti. Zamislite da dobijete komad čistog željeza sa zahtjevom da ga podijelite na hipotetske komponente koristeći bilo koji uređaj ili metodu koju su ikada izumili kemičari. Međutim, ne možete ništa učiniti, željezo se ne dijeli na nešto jednostavnije. Jednostavna supstanca - željezo - odgovara kemijskom elementu Fe. 
Teorijska definicija
Gore spomenuta eksperimentalna činjenica može se objasniti pomoću ove definicije: kemijski element je apstraktni skup atoma (ne molekula!) Od odgovarajuće jednostavne tvari, tj. Atoma iste vrste. Ako postoji način da se pogleda svaki od pojedinačnih atoma u komadu čistog željeza, kako je gore spomenuto, onda će svi biti isti - atomi željeza. Nasuprot tome, kemijski spoj, kao što je željezni oksid, uvijek sadrži najmanje dva različita tipa atoma: atome željeza i atome kisika.
Uvjeti koje trebate znati
Atomska masa : masa protona, neutrona i elektrona koji čine atom kemijskog elementa.
Atomski broj : broj protona u jezgri atoma elementa.
Kemijski simbol : slovo ili par latiničnih slova koji označavaju oznaku ovog elementa.
Kemijski spoj : Tvar koja se sastoji od dva ili više kemijskih elemenata koji su međusobno povezani u određenom omjeru.
Metal : element koji gubi elektrone kemijske reakcije s drugim elementima.
Metalloid : element koji ponekad reagira kao metal, a ponekad i kao metal.
Ne-metal : element koji nastoji proizvesti elektrone u kemijskim reakcijama s drugim elementima.
Periodni sustav kemijskih elemenata : sustav klasifikacije kemijskih elemenata u skladu s njihovim atomskim brojevima.
Sintetički element : onaj koji je umjetno dobiven u laboratoriju i, u pravilu, ne nalazi se u prirodi. 
Prirodni i sintetički elementi
Devedeset i dva kemijska elementa nalaze se u prirodi na Zemlji. Ostatak je dobiven umjetno u laboratorijima. Sintetički kemijski element obično je proizvod nuklearnih reakcija u akceleratorima čestica (uređaji koji se koriste za povećanje brzine subatomskih čestica, kao što su elektroni i protoni) ili nuklearni reaktori (uređaji koji se koriste za kontrolu energije koja se oslobađa tijekom nuklearnih reakcija). Prvi sintetički element dobiven atomskim brojem 43 bio je tehnecij, koji su 1937. otkrili talijanski fizičari C. Perrier i E. Segre. Uz tehnecij i prometij, svi sintetički elementi imaju jezgre veće od onih uranija. Potonji, koji je dobio ime, sintetski je kemijski element - livermorium (116), a prije njega bio je flamerij (114). 
Dvadeset zajedničkih i važnih elemenata
| ime | simbol | Postotak svih atoma * | Svojstva kemijskih elemenata (u normalnim sobnim uvjetima) | |||
| U svemiru | U Zemljinoj kori | U morskoj vodi | U ljudskom tijelu | |||
| aluminijum | al | - | 6.3 | - | - | Svijetlo srebrni metal |
| kalcijum | Ca | - | 2.1 | - | 0,02 | Uključeno u sastav prirodnih minerala, školjki, kostiju |
| ugljen | C | - | - | - | 10.7 | Osnova svih živih organizama |
| klor | cl | - | - | 0,3 | - | Otrovni plin |
| bakar | Cu | - | - | - | - | Samo crveni metal |
| zlato | au | - | - | - | - | Samo žuti metal |
| helijum | on | 7.1 | - | - | - | Vrlo lagan plin |
| hidrogen | H | 92,8 | 2.9 | 66.2 | 60,6 | Najlakši od svih elemenata; plina |
| jod | ja | - | - | - | - | nemetal; koristi se kao antiseptik |
| željezo | fe | - | 2.1 | - | - | Magnetski metal; nekad proizvodnja lijevanog željeza i postao |
| voditi | Pb | - | - | - | - | Mekani teški metal |
| magnezij | mg | - | 2.0 | - | - | Vrlo lagan metal |
| živa | Hg | - | - | - | - | Tekući metal; jedan od dva tekuća elementa |
| nikl | ni | - | - | - | - | Metali otporni na koroziju; koristi se u kovanicama |
| dušik | N | - | - | - | 2.4 | Plin, glavna komponenta zraka |
| kisik | oh | - | 60.1 | 33.1 | 25.7 | Plin, drugi važan komponenta zraka |
| fosfor | P | - | - | - | 0.1 | nemetal; važno za biljke |
| kalij | K | - | 1.1 | - | - | metal; važno za biljke; obično se naziva "potaša" |
* Ako vrijednost nije navedena, stavka je manja od 0,1 posto.
Veliki prasak kao temeljni uzrok stvaranja materije
Koji je bio prvi kemijski element u svemiru? Znanstvenici vjeruju da odgovor na to pitanje leži u zvijezdama i procesima u kojima nastaju zvijezde. Vjeruje se da je svemir nastao u nekom trenutku u vremenu od 12 do 15 milijardi godina. Do ovog trenutka ne razmišlja se ništa osim energije. No dogodilo se nešto što je pretvorilo tu energiju u veliku eksploziju (tzv. Veliki prasak). U sljedećim sekundama, nakon Velikog praska, stvar se počela stvarati.
Prvi protozojski oblici materije bili su protoni i elektroni. Neki od njih su spojeni u vodikove atome. Potonji se sastoji od jednog protona i jednog elektrona; to je najjednostavniji atom koji može postojati. 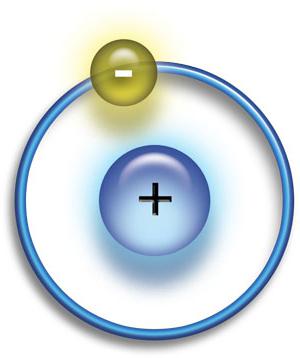 Polako, tijekom dugih vremenskih razdoblja, atomi vodika počeli su se skupljati u određenim prostorima, tvoreći guste oblake. Vodik u tim oblacima bio je kompaktan. gravitacijske sile. Na kraju, ovi oblaci vodika postali su dovoljno gusti da formiraju zvijezde ..
Polako, tijekom dugih vremenskih razdoblja, atomi vodika počeli su se skupljati u određenim prostorima, tvoreći guste oblake. Vodik u tim oblacima bio je kompaktan. gravitacijske sile. Na kraju, ovi oblaci vodika postali su dovoljno gusti da formiraju zvijezde ..
Zvijezde kao kemijski reaktori novih elemenata
Zvijezda je jednostavno masa tvari koja generira energiju nuklearnih reakcija. Najčešća od tih reakcija je kombinacija četiri atoma vodika koji tvore jedan atom helija. Čim su se počele stvarati zvijezde, helij je postao drugi element koji se pojavio u Svemiru.
Kada zvijezde postanu starije, one se kreću od nuklearnih reakcija vodikovog-helija do drugih vrsta. U njima atomi helija tvore ugljikove atome. Kasnije ugljikovi atomi tvore kisik, neon, natrij i magnezij. Još kasnije, neon i kisik kombiniraju se međusobno da bi formirali magnezij. Kako se te reakcije nastavljaju, stvaraju se sve više kemijskih elemenata.
Prvi sustavi kemijskih elemenata
Prije više od 200 godina, kemičari su počeli tražiti načine kako ih klasificirati. Sredinom devetnaestog stoljeća bilo je poznato oko 50 kemijskih elemenata. Jedno od pitanja koje kemičari pokušavaju riješiti. je li to: kemijski element je potpuno drugačija tvar od bilo kojeg drugog elementa? Ili neki elementi povezani s drugima na neki način? Postoji li opći zakon koji ih ujedinjuje?
Kemičari su predložili različite sustave kemijskih elemenata. Tako je, primjerice, engleski kemičar William Praut 1815. godine sugerirao da su atomske mase svih elemenata višestruke mase vodikovog atoma, ako je uzmemo za jednu, to jest, moraju biti cijele brojke. U to vrijeme, J. Dalton je već izračunao atomske mase mnogih elemenata u odnosu na masu vodika. Međutim, ako je to otprilike slučaj za ugljik, dušik, kisik, tada se klor s masom od 35,5 ne uklapa u ovu shemu.
Njemački kemičar Johann Wolfgang Dobereiner (1780.-1849.) Pokazao je 1829. da se tri elementa iz takozvane halogene skupine (klor, brom i jod) mogu klasificirati prema relativne atomske mase. Atomska težina broma (79,9) bila je gotovo točno prosjek atomskih težina klora (35,5) i joda (127), odnosno 35,5 + 127 = 2 = 81,25 (blizu 79,9). To je bio prvi pristup izgradnji jedne od skupina kemijskih elemenata. Dobereiner je otkrio još dva takva trijada elemenata, ali nije uspio formulirati opći periodični zakon.
Kako je periodički sustav kemijskih elemenata
Većina ranih klasifikacijskih shema nije bila uspješna. Zatim, oko 1869., dva kemičara su napravila gotovo jedno otkriće i gotovo u isto vrijeme. Ruski kemičar Dmitri Mendeljejev (1834.-1907.) I njemački kemičar Julius Lothar Meyer (1830.-1895.) Predložili su organiziranje elemenata koji imaju slične fizičke i kemijske osobine u uređen sustav skupina, redova i razdoblja. U isto vrijeme, Mendeleev i Meyer ukazali su da se svojstva kemijskih elemenata povremeno ponavljaju ovisno o njihovim atomskim težinama.
Danas se Mendelejev općenito smatra otkrivačem periodičnog zakona, jer je poduzeo jedan korak koji Meyer nije prihvatio. Kada su se svi elementi nalazili u periodnom sustavu, u njemu su se pojavile neke praznine. Mendeleev je predvidio da su to mjesta za elemente koji još nisu otkriveni.
Međutim, otišao je još dalje. Mendeleev je predvidio svojstva tih još neotvorenih elemenata. Znao je gdje se nalaze u periodnom sustavu, kako bi mogao predvidjeti njihova svojstva. Važno je napomenuti da svaki predviđeni kemijski element Mendelejeva, budući galij, skandij i germanij otkriveni su manje od deset godina nakon objavljivanja periodičnog zakona.
Kratki oblik periodnog sustava
Bilo je pokušaja da se izračuna koliko varijanti grafičke slike periodičkog sustava su predložili različiti znanstvenici. Pokazalo se da je više od 500. Štoviše, 80% od ukupnog broja varijanti su tablice, a ostalo su geometrijske figure, matematičke krivulje, itd. Kao rezultat toga, četiri vrste tablica pronašle su praktičnu primjenu: kratka, pola duga, duga i ljestve (piramidalna). Potonje je predložio veliki fizičar N. Bohr.
Donja slika prikazuje kratki obrazac. 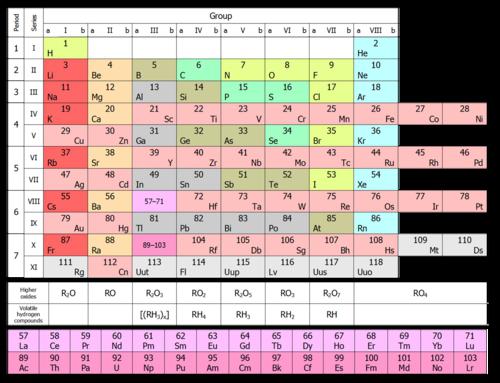 U njemu su kemijski elementi raspoređeni u rastućem redoslijedu njihovih atomskih brojeva s lijeva na desno i od vrha prema dnu. Dakle, prvi kemijski element periodnog sustava vodika ima atomski broj 1 jer jezgra vodikovih atoma sadrži jedan i samo jedan proton. Slično tome, kisik ima atomski broj 8, budući da jezgre svih atoma kisika sadrže 8 protona (vidi donju sliku).
U njemu su kemijski elementi raspoređeni u rastućem redoslijedu njihovih atomskih brojeva s lijeva na desno i od vrha prema dnu. Dakle, prvi kemijski element periodnog sustava vodika ima atomski broj 1 jer jezgra vodikovih atoma sadrži jedan i samo jedan proton. Slično tome, kisik ima atomski broj 8, budući da jezgre svih atoma kisika sadrže 8 protona (vidi donju sliku). 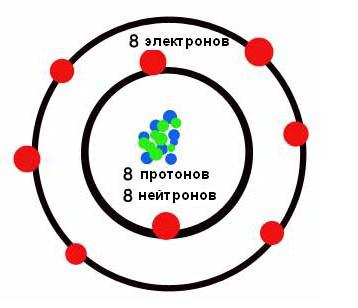
Glavni strukturni fragmenti periodnog sustava su razdoblja i skupine elemenata. U šest razdoblja sve stanice su popunjene, sedma još nije dovršena (elementi 113, 115, 117 i 118, iako sintetizirani u laboratorijima, još nisu službeno registrirani i nemaju imena).
Grupe su podijeljene u glavne (A) i sekundarne (B) podgrupe. Elementi prva tri razdoblja, koja sadrže svaki redak, uključena su isključivo u A-podgrupe. Preostala četiri razdoblja uključuju dva retka-redaka.
Kemijski elementi u jednoj skupini, u pravilu, imaju slična kemijska svojstva. Dakle, prva skupina je alkalijskih metala drugi je alkalna zemlja. Elementi u istom razdoblju imaju svojstva koja polako variraju od alkalnog metala do plemenitog plina. Donja slika pokazuje kako jedno od svojstava - atomski polumjer - varira za pojedine elemente u tablici.
Dugotrajni oblik periodnog sustava
Prikazan je na donjoj slici i podijeljen je u dva smjera, u redovima i stupcima. Postoji sedam redaka, kao u kratkom obliku, i 18 stupaca, koji se nazivaju grupe ili obitelji. Naime, povećanje broja skupina od 8 u kratkom obliku do 18 u duljinu dobiva se stavljanjem svih elemenata u razdobljima počevši od 4., ne u dva, nego u jednom retku.
Za grupe se koriste dva različita sustava numeriranja, kao što je prikazano na vrhu tablice. Sustav temeljen na rimskim brojevima (IA, IIA, IIB, IVB, itd.) Tradicionalno je popularan u Sjedinjenim Državama. Drugi sustav (1, 2, 3, 4, itd.) Tradicionalno se koristi u Europi i preporučen je za uporabu u SAD-u prije nekoliko godina.

Pojava periodnih tablica na gornjim slikama je pomalo varljiva, kao u svakoj takvoj objavljenoj tablici. Razlog tome je što bi se dvije skupine elemenata prikazane na dnu tablica trebale nalaziti unutar njih. Lantanidi, na primjer, spadaju u razdoblje 6 između barija (56) i hafnija (72). Osim toga, aktinidi spadaju u razdoblje 7 između radija (88) i rutherforda (104). Ako bi bili umetnuti u stol, postalo bi preširoko da bi se uklopio na list papira ili grafikona. Stoga je uobičajeno da se ti elementi smještaju na dno tablice.