Stupanj disocijacije, elektroliti i odredbe teorije elektrolitičke disocijacije
Ovaj članak je posvećen takvim pojmovima kao što su elektroliti i stupanj disocijacije, kao i opis teorije koja objašnjava mehanizme provođenja električne struje s otopinama različitih tvari.
Da li sve tvari vode struju?
Mnogi spojevi, ako su otopljeni u vodi ili rastaljeni, imaju sposobnost provoditi električnu struju. Na primjer, dobro je poznato da vodena otopina natrijevog klorida provodi dobro struju. Slično svojstvo ima talinu natrijevog klorida. Sve tvari koje provode struju u otopinama ili rastopinama su kombinirane pod nazivom elektroliti. Neelektroliti su spojevi koji nemaju sposobnost provođenja električne struje u otopinama i otopinama. Druga definicija elektrolita ih pozicionira kao tvari koje se rastvaraju u ione u otopinama ili se rastapaju. Ali rješenja mnogih drugih spojeva, naprotiv, ne mogu provoditi struju. Na primjer, otopina šećera, kao i većina organskih tvari. Vizualno uočite kretanje struje kroz otopinu elektrolita koja omogućuje sljedeće iskustvo. K električni krug spojene su dvije elektrode. Ako se spuste u otopinu elektrolita i zatvore krug, žaruljica svijetli. Obrnuta slika može se promatrati pomoću otopine neelektrolita.

Što su ove tvari
Elektroliti uključuju klase tvari kao što su baze, kiseline i velika većina soli. Gotovo svi su klasificirani kao neelektroliti. organski spojevi kao i tvari čije molekule posjeduju samo kovalentne nepolarne veze. Elektroliti se često nazivaju vodičima druge vrste. Zašto? Činjenica je da ovi spojevi sami po sebi, ne nalazeći se u stanju topljenja ili otopine, ne mogu djelovati kao vodiči električne struje. Svojstva pokazuju samo u rješenjima. To je zbog činjenice da se pri rastvaranju molekule elektrolita razgrađuju u ione koji postaju nositelji, transporteri električnog naboja. Budući da su u sastavu molekule, gube slična svojstva. To objašnjava zašto destilirana voda ne provodi struju.

Jaki elektroliti
Tvari kao što su elektroliti podijeljene su u dvije velike skupine. To su jaki i slabi elektroliti. Kako se te tvari međusobno razlikuju? Snažni elektroliti se potpuno razgrađuju u ione kada se otope u vodi. Na primjer, isto natrijev klorid. Takve supstance uključuju gotovo sve soli, baze aktivnih metala - alkalnu i zemno alkalnu, koje su u prve dvije skupine periodnog sustava DI Mendeleev, na primjer, kalij, natrij, magnezij i većina anorganskih kiselina. Na primjer, jaki elektroliti su sumporna, nitratna, klorovodična, bromovodična i mnoge druge kiseline.
Slabi elektroliti
Što se tiče spojeva koji se samo djelomično razgrađuju u ione u vodenoj otopini, nazivaju se slabi elektroliti. Važno je napomenuti da se velika većina organskih kiselina (octena, limunska, mliječna, oksalna i druge), mala količina anorganskih kiselina (ugljik, dušik, silicij i drugi), baze svih metala, s izuzetkom alkalnih i zemnoalkalnih kiselina, smatraju takvim tvarima. Voda također pripada slabim elektrolitima. Koncentracija iona za takve spojeve je vrlo mala.
Teorija elektrolitičke disocijacije
Kemikalije i fizičari davno su uočili svojstva gore opisanih tvari. Švedski znanstvenik Swante August Arrhenius razvio je teoriju elektrolitičke disocijacije kako bi objasnio ponašanje elektrolita u vodenim otopinama kako bi opisao mehanizam otapanja. Počeo je dobro, a njegovi sljedbenici dalje su sažimali i nadopunjavali ovu teoriju, koja nije izgubila pravdu u sadašnjosti. U otopinama se molekule elektrolita razgrađuju u čestice s pozitivnim ili negativnim nabojem. Ovaj proces je znanstvenik koji se zove elektrolitička disocijacija. U srcu učenja Arrheniusa nalaze se tri odredbe. Razmotrite svaku od njih.

Postavite jednu
Elektroliti u procesu otapanja ili topljenja raspadaju se u negativne i pozitivno nabijene čestice - ione. Oni mogu biti jednostavni i složeni. Primjeri jednostavnih iona su K + , Mg2 + , Na + . Kompleks se može pripisati SO 4 2- , NO 3 - i drugima.
Drugo mjesto
Utjecaj električne struje vodi do toga da se ioni počinju kretati u određenom smjeru. S takvim pokretom, negativno nabijene čestice kreću se prema anodi, a pozitivno nabijene čestice se kreću prema katodi. U tom smislu, prvi je dobio ime aniona, a drugi kationi. Zašto dolazi do smjera kretanja iona? To je zbog činjenice da suprotno nabijene elektrode privlače odgovarajuće čestice.
Pozicija tri
Disocijacija je reverzibilni proces, budući da istodobno s razgradnjom nekih molekula na ione nastaje i druga stvar zbog kombinacije iona (tzv. Asocijacija). Taj je proces vrlo dinamičan, a raspad nekih molekula stalno se zamjenjuje kombinacijom drugih. Teorija koju je utemeljio S. Arrhenius postala je jedna od najvažnijih teorija moderne anorganske kemije.
Mehanizam disocijacije
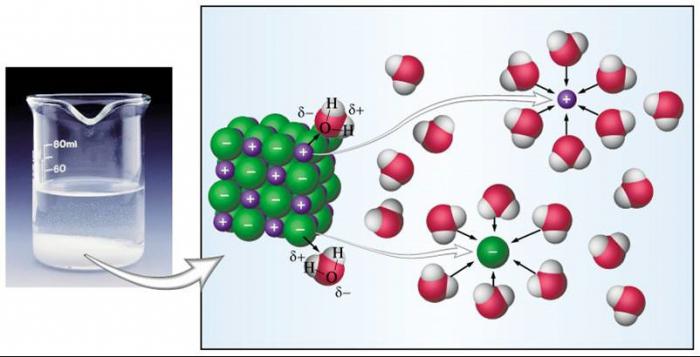
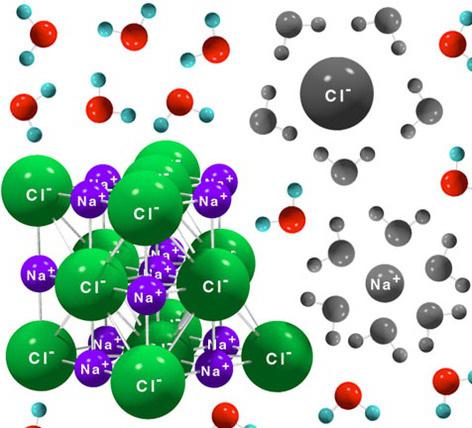
Ionska veza je odlučujuća u sposobnosti tvari da se disocira u ione u vodenoj otopini. Spojevi s ovom vrstom veze u njihovim molekulama razgrađuju se brže i lakše od drugih tvari. Svaka molekula vode ima dva suprotno nabijena pola ili dipola. S jedne strane - kisik, as druge - vodik. Zbog ove raspodjele naboja u molekuli vode dolazi do razgradnje u ione otopljenih spojeva, koji su elektroliti. Ioni koji sačinjavaju molekule takvih elektrolita, kada su disocirani, privučeni su dipolima vode, koji okružuju svaki ion, kao što je i bio, razdvajajući ga. Takav mehanizam se temelji na uzajamnim privlačnim silama suprotnih naboja. Ioni okruženi molekulama vode nazivaju se hidrirani. Po istom principu dolazi do disocijacije tvari koje imaju polarne kovalentne veze u njihovim molekulama. Ali ako se ionske tvari potpuno razgrađuju, onda među polarnim elektrolitima ima mnogo onih koji se djelomično razdvajaju.

Stupanj disocijacije
Dakle, elektroliti su tvari čiji su atomi u molekulama vezani ili ionskom ili kovalentnom polarnom vezom. Glavne skupine takvih spojeva su kiseline, soli i baze. Kiseline se odvajaju s nastajanjem vodikovih iona i kiselih ostataka, baza - ioni metala i hidroksilne skupine, ioni soli - metali i kiselinski ostaci. Prema trećem položaju elektrolitičke disocijacije, raspad elektrolita u ione je reverzibilan proces. To znači da u otopini postoje i pojedinačni ioni i cijele molekule. To je omogućilo znanstvenicima da uvedu takvu vrijednost kao stupanj disocijacije. To je omjer broja molekula n podijeljenih na ione na ukupan broj molekula elektrolita N. Stupanj disocijacije ima svoju oznaku - α. Sve se to može izraziti formulom α = n / N. Što se više molekula razgrađuje na ione, to je veći stupanj disocijacije. I što će se dogoditi ako se sve molekule elektrolita razbiju u ione? U takvim slučajevima, stupanj disocijacije će biti jednak jednom, a to je najveća vrijednost koju može uzeti. To je u pravilu karakteristično za jake elektrolite koji se potpuno razgrađuju u ione u vodenoj otopini. Osim udjela, jedinice konstante i stupanj disocijacije mogu se izraziti kao postotak. Taj broj ne ovisi samo o prirodi elektrolita, već io takvim uvjetima kao što su temperatura otopine i njezina koncentracija. Konstanta disocijacije je omjer koncentracija iona elektrolita u otopini i koncentraciji cijelih molekula. Osim toga, za otopine jakih elektrolita uvedena je takva stvar kao prividni stupanj disocijacije. Činjenica je da otopine jakih elektrolita nemaju molekule koje se ne rastvaraju u nabijene čestice, a takvo rješenje ima posebnu ionsku strukturu, koja nešto mijenja njegova svojstva. Stoga uobičajeni stupanj disocijacije nije primjenjiv na njega. Prividni stupanj disocijacije može se shvatiti kao uvjetan, jer je nemoguće odustati od te vrijednosti za otopine jakih elektrolita, ali u isto vrijeme njegova vrijednost gotovo uvijek ostaje ista, ne odstupajući od jedinstva.