Opća formula amina. Svojstva i struktura amina
Organske baze - ovaj se naziv često koristi u kemiji za spojeve dobivene iz amonijaka. Atomi vodika u njegovoj molekuli zamijenjeni su ugljikovodičnim radikalima. Riječ je o aminima - spojevima koji ponavljaju kemijska svojstva amonijaka. U članku ćemo se upoznati s općom formulom amina i njihovim svojstvima.
Molekularna struktura
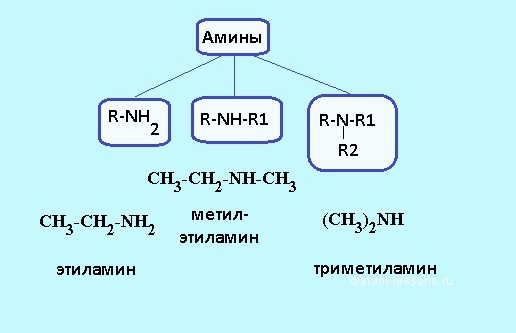
Ovisno o tome koliko je vodikovih atoma zamijenjeno radikalima ugljikovodika, razlikuju se primarni, sekundarni i tercijarni amini. Na primjer, metilamin je primarni amin u kojem je vodikova čestica zamijenjena skupinom -CH3. Strukturna formula amina je R-NH2, može se koristiti za određivanje sastava organske tvari. Primjer sekundarnog amina može biti dimetilamin, koji ima sljedeći oblik: NH2-NH-NH2. U molekulama tercijarnih spojeva sva tri atoma vodika amonijaka zamjenjuju se ugljikovodičnim radikalima, na primjer trimetilamin ima formulu (NH2) 3N. Struktura amina utječe na njihova fizička i kemijska svojstva.
Fizičke značajke
Agregatno stanje amina ovisi o tome što molarna masa radikali. Što je manji, to je niža specifična težina tvari. Amini niže klase su predstavljeni plinovima (na primjer, metilaminom). Imaju izražen miris amonijaka. Srednji amini su blago mirisne tekućine, a spojevi s velikom masom ugljikovodičnih radikala su bez mirisa. Topivost amina također ovisi o masi radikala: što je veća, to se tvar rastvara u vodi. Tako struktura amina određuje njihovo fizičko stanje i karakteristike.
Kemijska svojstva
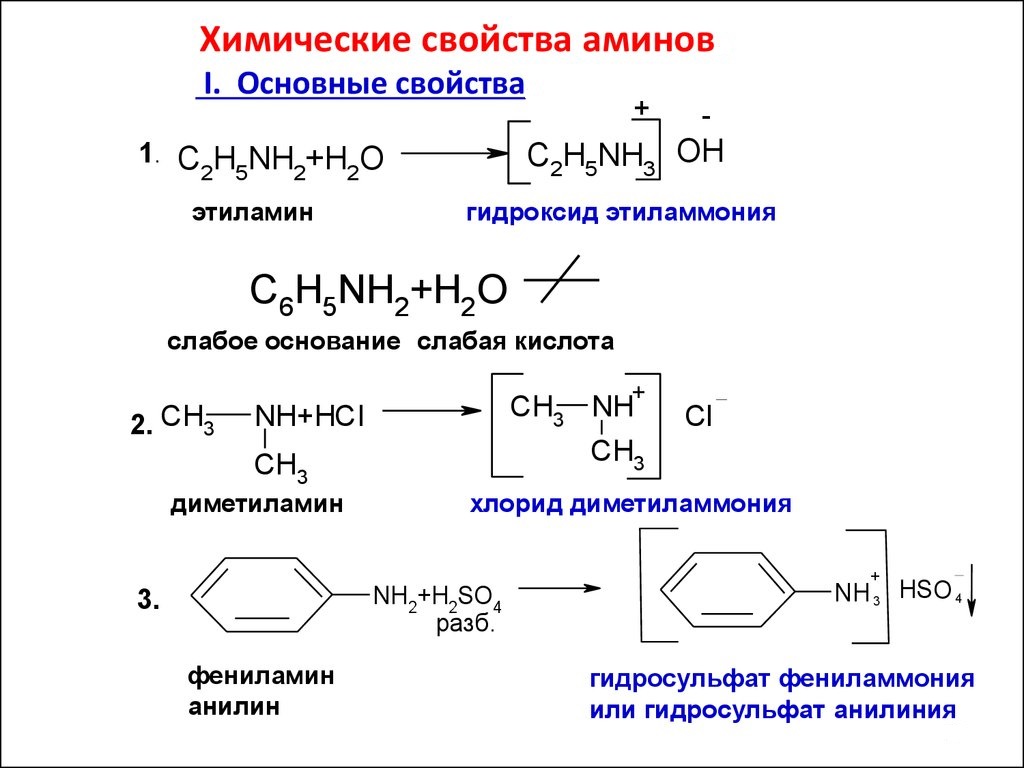
Karakteristika tvari ovisi uglavnom o transformacijama amino skupine u kojima je vodeća uloga dodijeljena njegovom usamljenom elektronskom paru. Kao i organska tvar amini su derivati amonijaka, sposobni su za reakcije karakteristične za NH3. Na primjer, spojevi se otapaju u vodi. Produkti ove reakcije bit će tvari koje pokazuju svojstva hidroksida. Na primjer, metilamin, čiji atomski sastav udovoljava općoj formuli zasićenih amina R-NH2, s vodom tvori spoj, metil amonijev hidroksid:
CH3-NH2 + H20 = [CH3-NH3] OH
Organske baze u interakciji s anorganskim kiselinama, a sol je otkrivena u proizvodima. Tako metilamin s klorovodičnom kiselinom daje metil amonij klorid:
CH3-NH2 + HCl -> [CH3NH3] Cl
Reakcije amina, čija je opća formula R-NH2, s organske kiseline su zamijenjeni zamjenom vodikovog atoma amino skupine sa kompleksnim anionom kiselinskog ostatka. Nazivaju se reakcije alkilacije. Kao u reakciji s nitritnom kiselinom, acilni derivati mogu tvoriti samo primarne i sekundarne amine. Trimetilamin i drugi tercijarni amini nisu sposobni za takve interakcije. Također dodajemo da se alkilacija u analitičkoj kemiji koristi za odvajanje smjesa amina, također služi kvalitativni odgovor na primarnim i sekundarnim aminima. Kod cikličkih amina važan je anilin. Ekstrahira se iz nitrobenzena redukcijom potonjeg s vodikom u prisutnosti katalizatora. Anilin je sirovina za proizvodnju plastike, bojila, eksploziva i lijekova.

Značajke tercijarnih amina
Tercijarni derivati amonijaka razlikuju se po kemijskim svojstvima od jedno- ili dvo-supstituiranih spojeva. Na primjer, mogu djelovati s halogenim derivatima zasićenih ugljikovodika. Kao rezultat nastaju tetraalkilamonijeve soli. Srebrni oksid reagira s tercijarnim aminima, dok se amini pretvaraju u tetraalkilamonijeve hidrokside, koji su jake baze. Mogu se tvoriti aprotične kiseline, kao što je bor trifluorid, s trimetilaminom kompleksni spojevi.
Kvalitativni test za primarne amine
Dušična kiselina može poslužiti kao reagens s kojim se mogu detektirati jedan ili dva supstituirana amina. Budući da ne postoji u slobodnom stanju, da bi se dobila u otopini, prvo se provodi reakcija između razrijeđene kloridne kiseline i natrijevog nitrita. Zatim dodajte otopljeni primarni amin. Sastav njegovih molekula može se izraziti korištenjem opće formule amina: R-NH 2. Ovaj proces je popraćen pojavom molekula nezasićenih ugljikovodika, koji se mogu odrediti reakcijom s bromnom vodom ili otopinom kalijevog permanganata. Izonitrilna reakcija može se smatrati kvalitativnom. U njemu primarni amini reagiraju s kloroformom u mediju s prekomjernom koncentracijom hidroksilnih aniona. Rezultat je stvaranje izonitrila s neugodnim specifičnim mirisom.

Značajke reakcije sekundarnih amina s nitritnom kiselinom
Tehnologija za proizvodnju HNO2 reagensa opisana je iznad. Zatim se u otopinu koja sadrži reagens doda organski derivat amonijaka koji sadrži dva ugljikovodična radikala, na primjer, dietilamin, čija molekula odgovara općoj formuli sekundarnih amina NH2-R-NH2. U reakcijskim proizvodima nalazimo nitro spoj: N-nitrozodietilamin. Ako se na nju djeluje kloridnom kiselinom, spoj se razlaže na kloridnu sol početnog amina i nitrosil klorida. Također dodamo da tercijarni amini nisu sposobni za reakcije s dušičnom kiselinom. To se objašnjava sljedećom činjenicom: nitritna kiselina pripada slabim kiselinama, a njezine soli, u interakciji s aminima koji sadrže tri ugljikovodične radikale, potpuno se hidroliziraju u vodenim otopinama.
Načini za dobivanje
Amini, čija je opća formula R-NH2, mogu se dobiti redukcijom spojeva koji sadrže dušik. Na primjer, to može biti redukcija nitroalkana u prisutnosti katalizatora - metalnog nikla - kada se zagrije na +50 ° C i pri tlaku do 100 atm. Nitroetan, nitropropan ili nitrometan se pretvaraju u amine kao rezultat ovog postupka. Tvari ove klase mogu se također dobiti redukcijom vodika nitrilne skupine spojeva. Ta reakcija se odvija u organskim otapalima, uz prisutnost niklovog katalizatora. Ako se kao reducirajuće sredstvo koristi metalni natrij, u tom slučaju se postupak provodi u alkoholnoj otopini. Navedimo još dva načina: aminaciju halogenalkana i alkohola.
U prvom slučaju nastaje smjesa amina. Aminacija alkohola provodi se na sljedeći način: mješavina para metanola ili etanola s amonijakom prelazi preko kalcijevog oksida, koji djeluje kao katalizator. Dobiveni primarni, sekundarni i tercijarni amini mogu se obično razdvojiti destilacijom.
U članku smo proučavali strukturu i svojstva organskih spojeva koji sadrže dušik - amine.