Thomsonov atomni model: opis i pobijanje
Thomsonov atomski model - jedan od najranijih modela struktura atoma naknadno priznata kao nesolventna. Prvi je predložio DD. Thomson 1904., ubrzo nakon otkrića elektrona, ali prije otkrića atomske jezgre.
prapovijest
Godine 1897. dogodio se značajan događaj u fizici: Thompson Joseph John je otkrio elektrone, eksperimentalno potvrđujući pretpostavku da atom nije "monolitna" čestica. Međutim, nije bilo točne predodžbe o tome što su osnovne čestice. Tek će 1911. godine biti predstavljen točniji model Rutherfordovog atoma, a prije toga se znanstveni svijet mahnito borio s "misterijom stoljeća".

Odgovor na upit
Nakon niza eksperimenata, ispostavilo se da su elektroni negativno nabijeni, au međuvremenu je već bilo poznato da atomi imaju neutralan naboj. Thomson je razumno predložio da bi atom trebao imati određeni izvor pozitivnog naboja koji bi kompenzirao negativan naboj elektrona.
Engleski fizičar predstavio je tri moguća mehanizma interakcije unutar čestica.
- U prvom modelu Thomsonova atoma, svaki negativno nabijeni elektron se držao pozitivno nabijene čestice koja ga je slijedila svugdje unutar atoma.
- U drugom modelu, elektroni se okreću oko središnjeg područja pozitivnog naboja, koji ima istu veličinu kao i svi elektroni.
- U trećem modelu, elektroni su zauzimali prostor prostora, koji je sam po sebi bio jednoličan pozitivni naboj (često nazvan "juha" ili "oblak" pozitivnog naboja).
Znanstvenik je izabrao treću opciju - najvjerojatniju strukturu atoma.

Pozornost javnosti
Thomsonov atomski model 1904. objavljen je u ožujskom broju Philosophical Magazine, autoritativnom znanstvenom časopisu Britanije. Prema autoru, atomi elemenata sastoje se od niza negativno naelektriziranih krvnih zrnaca (elektrona), zatvorenih u sferu jednolične pozitivne elektrifikacije. Thomson je napustio svoju raniju hipotezu o "maglovitom atomu", u kojem se čestice sastoje od nematerijalnih vrtloga.
Publikacija je izazvala istinski interes za znanstvenu zajednicu. Međutim, ona nije imala čvrste dokaze i stoga je bila kritizirana od strane mnogih autoritativnih fizičara. Međutim, to je odgovaralo idejama i eksperimentalnim podacima koji su tada bili poznati.
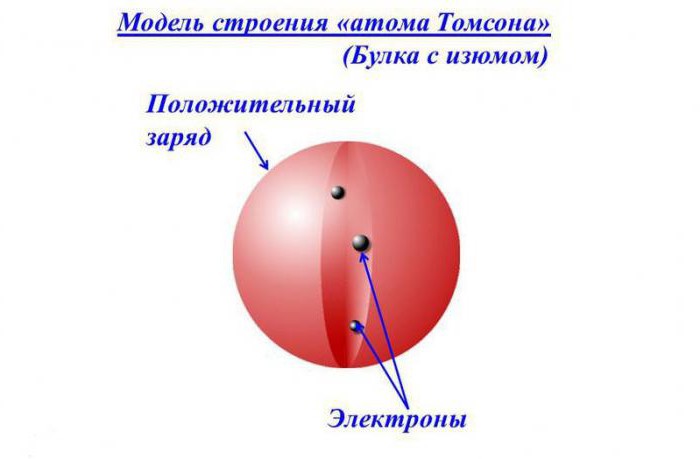
Opis modela
Pronicljiv i praktičan znanstvenik, Thomson je svoj atomski model temeljio na dobro poznatim eksperimentalnim podacima. Prijedlog za pozitivni iznos naknade odražava prirodu njegovog znanstvenog pristupa otkriću, koji je postao vodič za akciju za buduće eksperimente.
Prema teoriji, orbite elektrona unutar Thomsonova atomskog modela stabilizirane su činjenicom da je, kada se elektron udaljio od središta pozitivno nabijene sfere (oblaka), bio izložen povećanju. privlačne sile. Ta sila vraća elektron nazad, jer prema Gaussovom zakonu postoji veća koncentracija pozitivnog naboja unutar kugle. Prema modelu, elektroni bi se mogli slobodno rotirati u prstenovima, koji su dodatno stabilizirani interakcijom elektrona, a spektroskopske vrijednosti objasnile su razlike u energiji između pojedinih kružnih orbita.
Prema ideji tog vremena, elektroni su bili smješteni u pozitivno nabijenoj sferi poput grožđica u piti ili komadići voća u britanskom omiljenom desertu - pudingu od šljive. Stoga se koncept naziva i modelom "pudinga" atoma.
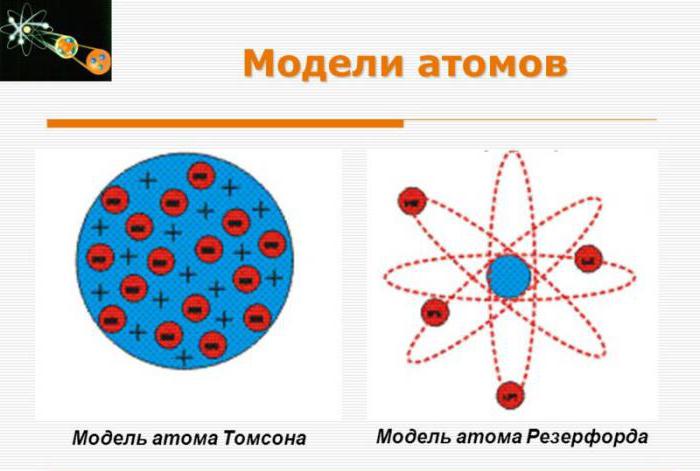
Dilema nedosljednosti
Uz akumulaciju eksperimentalnih podataka, sve se jasnije primjećuje nedosljednost te teorije. Thomson je bezuspješno pokušao preoblikovati svoj model kako bi objasnio neke od glavnih spektralnih linija koje su eksperimentalno identificirane za nekoliko elemenata.
Godine 1909. Hans Geiger i Ernest Marsden pod nadzorom profesora Ernest Rutherford provodili su pokuse s tankim listom zlata, raspršujući alfa čestice na zlatnu foliju. Podaci su se razlikovali od očekivanih. Godine 1911. Rutherford je nakon mnogo razmišljanja objavio svoj vlastiti koncept, koji se kasnije nazvao Rutherfordovim atomskim modelom. Pretpostavio je prisutnost vrlo male jezgre s najsnažnijim pozitivnim nabojem u središtu atoma zlata, što je dovoljno za držanje oko stotinu elektrona.
Daljnji razvoj
Odmah nakon što je Rutherford objavio svoje rezultate, Antonius Van den Broek intuitivno je sugerirao da je atomski broj elementa ukupan broj jedinica naboja prisutnih u njegovoj jezgri. Henry Mosley 1913. dao je potrebne podatke kako bi dokazao Van den Bruckov prijedlog. Utvrđeno je da efektivno nuklearno punjenje odgovara atomskom broju.
Ovaj rad poslužio je kao osnova Nielsu Bohru da 1913. godine stvori poluklasični model atoma. Podsjeća na interakciju svjetiljki i planeta u Sunčevom sustavu, ali samo s kvantnim ograničenjima.

Vrijednost za znanost
Thomsonov atomski model bio je poticaj za brzi razvoj nuklearne fizike. Koncept "pudinga šljiva" s jednim elektronom upotrijebio je fizičar Arthur Erich Haas 1910. godine za procjenu numeričke vrijednosti Plankove konstante i Borovog radijusa vodikovih atoma. Haasovo djelo objavljeno je tri godine prije zaključaka Nielsa Bohra. Treba napomenuti da Bohrov model pruža prilično točna predviđanja za atomske i ionske sustave koji imaju jedan učinkovit elektron.
Osim toga, teorija "pudinga" omogućuje vam da odredite optimalnu raspodjelu jednakih točaka na jediničnoj sferi, nazvanoj Thomsonov problem. Usput, fizički sustav utjelovljen u Thomsonovom problemu je poseban slučaj jednog od osamnaest neriješenih matematičkih problema koje je predložio matematičar Steve Smale - “Raspodjela točaka na dvodimenzionalnoj sferi”.
Thomsonov problem je prirodna posljedica modela "pudinga snopa" u odsutnosti jednoličnog pozitivnog pozadinskog naboja. Elektrostatička interakcija elektrona vezanih sferičnim kvantnim točkama također je analogna njihovoj obradi u Thomsonovom atomskom modelu. U ovom klasičnom problemu, kvantna se točka modelira kao jednostavna dielektrična kugla (umjesto homogene, pozitivno nabijene sfere, kao u modelu "pudinga snopa"), u kojoj postoje slobodni ili višak elektrona.