Benzen: formula. Benzen: elektronička struktura, svojstva
Aromatski ugljikovodici važan su dio cikličkih serija organski spojevi. Najjednostavniji predstavnik takvih ugljikovodika je benzen. Formula te supstance ne samo da ju je razlikovala od brojnih drugih ugljikovodika, već je također dala poticaj razvoju novog smjera u organskoj kemiji.
Otkriće aromatskih ugljikovodika
Aromatski ugljikovodici otkriveni su početkom 19. stoljeća. U to vrijeme, najčešće gorivo za uličnu rasvjetu bilo je osvjetljavanje plina. Iz njegovog kondenzata, veliki engleski fizičar Michael Faraday izdvojio je 1825. tri grama masne tvari, detaljno opisao njegova svojstva i nazvao ga: ugljikovodikom. Godine 1834., njemački znanstvenik, kemičar Mitscherlich, zagrijavajući benzojevu kiselinu vapnom, dobio je benzen. Formula ispod koje je ova reakcija nastavljena prikazana je u nastavku:
C6H5COOH + CaO fuzija C6H6 + CaC03.
Tada je iz benzoične smole dobivena rijetka benzojeva kiselina, koju mogu izdati neke tropske biljke. Godine 1845. pronađen je novi spoj u ugljenom katranu, koji je bio prilično pristupačna sirovina za dobivanje nove tvari u industrijskom mjerilu. Drugi izvor benzena je ulje proizvedeno na nekim poljima. Kako bi se zadovoljile industrijske potrebe benzena, također se dobiva aromatizacijom određenih skupina acikličkih naftnih ugljikovodika.
Moderna verzija imena koju je predložio njemački znanstvenik Liebig. Korijen riječi "benzen" treba tražiti na arapskom jeziku - tamo se prevodi kao "tamjan".
Fizikalna svojstva benzena
Benzen je bezbojna tekućina specifičnog mirisa. Ova tvar kuha na temperaturi od 80,1 o C, stvrdnjava na 5,5 o C i pretvara se u bijeli kristalni prah. Benzen praktički ne provodi toplinu i električnu energiju, slabo je topljiv u vodi i dobro - u raznim uljima. Aromatska svojstva benzena odražavaju bit strukture njegove unutarnje strukture: relativno stabilnu benzensku jezgru i neodređeni sastav.
Kemijska klasifikacija benzena

Benzen i njegovi homolozi - toluen i etilbenzen - su aromatski niz cikličkih ugljikovodika. Struktura svake od tih tvari sadrži zajedničku strukturu nazvanu benzenski prsten. Struktura svake od gore navedenih tvari sadrži posebnu cikličku grupaciju koju stvara šest ugljikovih atoma. To se naziva benzenski aromatski prsten.
Povijest otkrića
Uspostavljanje unutarnje strukture benzena protezalo se tijekom nekoliko desetljeća. Osnovne principe strukture (prstenasti model) predložio je 1865. kemičar A. Kekule. Kao što legenda kaže, njemački znanstvenik vidio je formulu ovog elementa u snu. Kasnije je predloženo da se pojednostavi pisanje strukture tvari, tzv. Benzena. Formula za ovu tvar je šesterokut. Izostavljaju se simboli ugljika i vodika, koji se trebaju nalaziti na uglovima šesterokuta. Dakle, ispada jednostavno pravilan šesterokut s naizmjeničnim jednostrukim i dvostrukim linijama sa strane. Opća formula benzena prikazana je na slici ispod. 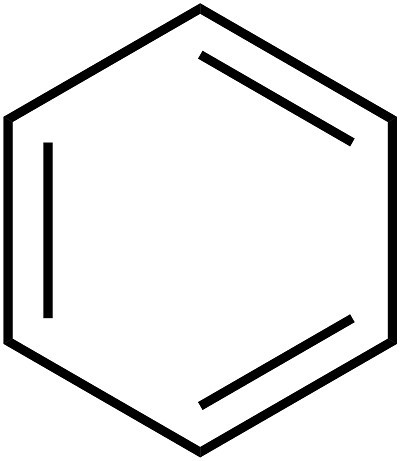
Aromatski ugljikovodici i benzen
Kemijska formula ovog elementa upućuje na to da su reakcije adicije neobične za benzen. Za nju, kao i za druge elemente aromatskih nizova, karakteristične su reakcije supstitucije vodikovih atoma u benzenskom prstenu.
Reakcija sulfoniranja
Prilikom osiguravanja koncentracije sumporna kiselina i benzen, podizanjem temperature reakcije, mogu se dobiti benzosulfonska kiselina i voda. Strukturna formula benzena u ovoj reakciji je sljedeća: 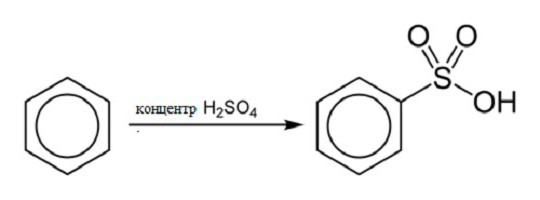
Reakcija halogeniranja
Brom ili krom u prisutnosti katalizatora reagira s benzenom. To proizvodi halogene derivate. No, reakcija nitriranja odvija se pomoću koncentriranog dušična kiselina. Konačni rezultat reakcije je spoj dušika:
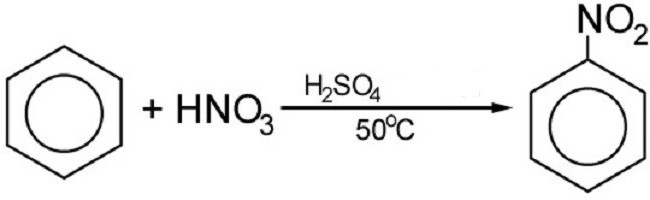
Pomoću nitriranja dobiva se eksploziv poznat svima - trotil ili trinitotoluen. Malo ljudi zna da je benzol osnova tole. Mnogi drugi nitro spojevi na bazi benzenskog prstena također se mogu koristiti kao eksplozivi.
Elektronska formula benzena
Standardna formula benzenskog prstena ne odražava točno unutarnju strukturu benzena. Prema tome, benzen mora imati tri lokalizirane p-veze, od kojih svaka mora djelovati s dva ugljikova atoma. No, kako iskustvo pokazuje, benzen nema uobičajene dvostruke veze. Molekulska formula benzena omogućuje da se vidi da su sve veze u benzenskom prstenu ekvivalentne. Svaka od njih ima duljinu od oko 0.140 nm, što je među-vrijednost između duljine standardne jednostavne veze (0.154 nm) i dvostruke etilenske veze (0.134 nm). Strukturna formula benzena, prikazana naizmjeničnim vezama, nesavršena je. Uvjerljiviji trodimenzionalni model benzena, koji izgleda kao što je prikazano na slici ispod. 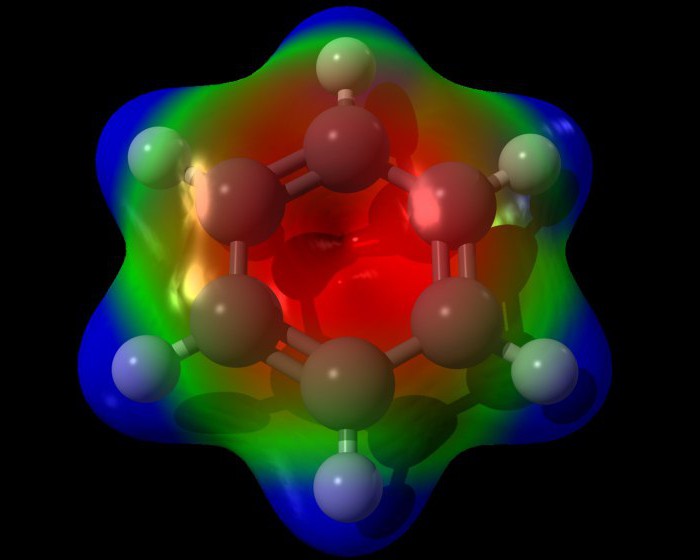 Svaki od atoma benzenskog prstena nalazi se u stanju sp2 hibridizacije. On troši na stvaranje sigma veza na tri valentna elektrona. Ovi elektroni obuhvaćaju dva susjedna atoma ugljikohidrata i jedan vodikov atom. U ovom slučaju, i elektroni i veze C - C, H - H su u istoj ravnini.
Svaki od atoma benzenskog prstena nalazi se u stanju sp2 hibridizacije. On troši na stvaranje sigma veza na tri valentna elektrona. Ovi elektroni obuhvaćaju dva susjedna atoma ugljikohidrata i jedan vodikov atom. U ovom slučaju, i elektroni i veze C - C, H - H su u istoj ravnini.
Četvrti valentni elektron formira oblak u obliku volumetrijske figure osam, koja je smještena okomito na ravninu benzenskog prstena. Svaki takav oblak elektrona preklapa se iznad ravnine benzenskog prstena i neposredno ispod njega s oblacima dvaju susjednih atoma ugljika.
Gustoća oblaka p-elektrona ove tvari ravnomjerno je raspodijeljena između svih ugljikovih veza. Na taj se način formira jedan kružni elektronski oblak. U općoj kemiji, ova struktura se naziva aromatski elektronski sekstet.
Jednaka vrijednost unutarnjih veza benzena
Upravo ekvivalentnost svih strana šesterokuta objašnjava ravnomjernost aromatskih veza, koje uzrokuju karakteristična kemijska i fizikalna svojstva benzena. U nastavku je prikazana formula za ravnomjernu raspodjelu p-elektronskog oblaka i ekvivalentnost svih njegovih unutarnjih veza.
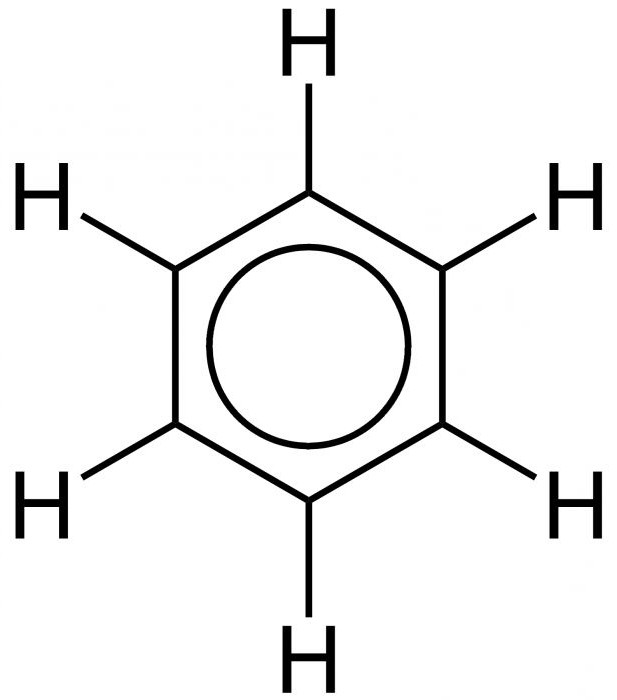
Kao što se može vidjeti, umjesto izmjeničnih pojedinačnih i dvostrukih značajki, unutarnja se struktura prikazuje kao krug.
Suština unutarnje strukture benzena daje ključ za razumijevanje unutarnje strukture cikličkih ugljikovodika i proširuje mogućnosti praktične primjene tih tvari.