Ugljična kiselina: što znamo o tome?
Što osoba više uči o svijetu oko sebe, to je svjesnija ograničenja i nesavršenosti svoga znanja. Uzmite za primjer soda voda. Kao što znate, ovo se piće razlikuje od ostalih po tome što sadrži ugljičnu kiselinu u malim dozama, koja se odmah počinje raspadati čim odvrnemo čep na bocu.  Stoga u udžbeniku kemije nema sumnje da je ta tvar izuzetno nestabilna. U plinskoj fazi se vrlo brzo pretvara u mješavinu obične vode i uobičajene ugljični dioksid. Međutim, kao što pokazuju nedavne studije, to je sasvim moguće argumentirati. Ali prvo, zapamtimo što je supstanca.
Stoga u udžbeniku kemije nema sumnje da je ta tvar izuzetno nestabilna. U plinskoj fazi se vrlo brzo pretvara u mješavinu obične vode i uobičajene ugljični dioksid. Međutim, kao što pokazuju nedavne studije, to je sasvim moguće argumentirati. Ali prvo, zapamtimo što je supstanca.
Što je ugljična kiselina?
Formula ovog kemijskog spoja izgleda vrlo jednostavno: H 2 CO 3 . Prisutnost dva atoma vodika ukazuje da je ova kiselina dibazična, a njezina nestabilnost ukazuje na njenu slabost. Poznato je da se kiselina disocira u vodi, a dotični spoj ne potpada pod iznimku. Međutim, postoji jedna značajka: zbog prisutnosti dvije baze, taj se proces odvija u dvije faze:
H2CO3H + + HCO3-,
NSO 3 - + N + + SO3 2- .
U interakciji s jakom bazom ugljična kiselina formira normalne ili kisele karbonate. Potonji se razlikuju po tome što ne zamjenjuju dva, nego samo jedan atom vodika. Izvanredan primjer normalnog karbonata je soda za pranje (Na2C03), a soda bikarbone (NaHCO3) može igrati ulogu uzorka bikarbonata. 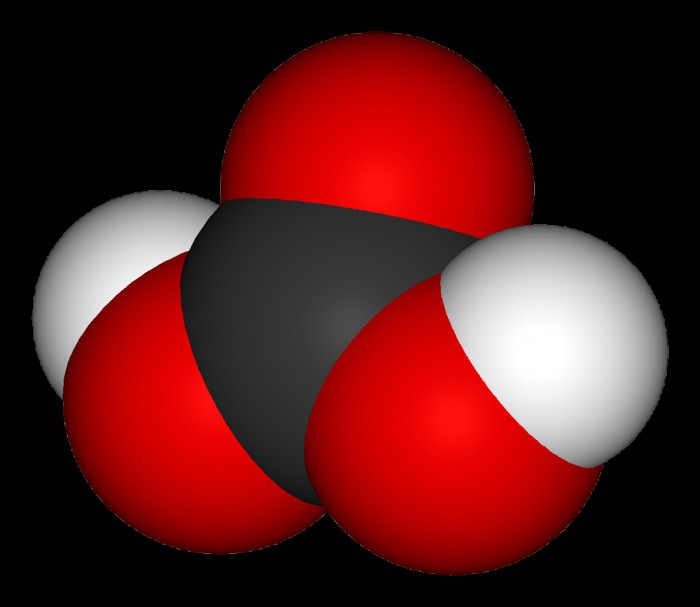
Što su znanstvenici otkrili?
Kada se protonira bezvodni kalijev bikarbonat (KNSO 3 ) na temperaturi od -110 ° C, vodik izbacuje atom K. Rezultat je vrlo čista ugljična kiselina. Kasnije je otkriven još lakši način zagrijavanja u vakuumu NH 4 HCO 3 . Kao rezultat te razgradnje amonij bikarbonata, oslobađa se amonij i nastaje bezvodna ugljična kiselina. Ovo posljednje pokazuje nevjerojatnu stabilnost kada se sublimira u vakuumu. Kada su znanstvenici počeli istraživati taj paradoks, ispostavilo se da je razlog u energetskoj barijeri. Za bezvodni H 2 CO 3, on je 44 kcal / mol, a kada je voda, njegova vrijednost je gotovo dva puta manja - 24 kcal / mol. Dakle, pod odgovarajućim uvjetima, ugljična kiselina može ostati u slobodnom obliku. Međutim, ovo je otkriće zanimljivo ne samo sa stajališta teorije kemije. Njegova praktična vrijednost je da je omogućio novi način proučavanja procesa disanja. Sada znanstvenici vjeruju da je stvaranje ugljične kiseline u živom organizmu ubrzano uz pomoć posebnog enzima, a to je upravo ono što vam omogućuje da brzo uklonite ugljični dioksid iz stanica, najprije u krv, a zatim u pluća.  Ovo otkriće također nije propustilo iskoristiti prednosti astronoma: slobodno stanje ugljičnog dioksida im je omogućilo da ga zadrže spektralna analiza i sada se ta povezanost može prepoznati u atmosferi planeta oko nas. Sve to sugerira da je svijet još uvijek pun raznih tajni i tajni. Čini se da će se moderni udžbenici morati ponovno pisati više puta, prerađivati stare i otvarati nova znanja.
Ovo otkriće također nije propustilo iskoristiti prednosti astronoma: slobodno stanje ugljičnog dioksida im je omogućilo da ga zadrže spektralna analiza i sada se ta povezanost može prepoznati u atmosferi planeta oko nas. Sve to sugerira da je svijet još uvijek pun raznih tajni i tajni. Čini se da će se moderni udžbenici morati ponovno pisati više puta, prerađivati stare i otvarati nova znanja.