Ugljični dioksid: svojstva, proizvodnja, primjena
Vi već znate da dok izdišete ugljični dioksid izlazi iz pluća. Ali što znate o toj tvari? Vjerojatno malo. Danas ću odgovoriti na sva pitanja vezana uz ugljični dioksid.

definicija
Ova tvar u normalnim uvjetima je bezbojni plin. U mnogim se izvorima može nazvati drugačije: i ugljikov monoksid (Iv) i ugljičnog anhidrida, te ugljičnog dioksida i ugljičnog dioksida.
nekretnine
Ugljični dioksid (formula CO 2 ) je bezbojni plin kiselog mirisa i okusa, u vodi topljiva tvar. Ako se pravilno ohladi, formira se snježna masa nazvana suhim ledom (slika dolje), koja sublimira na -78 o C.  Jedan je od proizvoda propadanja ili spaljivanja bilo kojeg organska tvar. Otopi se u vodi samo na temperaturi od 15 ° C i samo ako je omjer vode i ugljičnog dioksida 1: 1. Gustoća ugljičnog dioksida može biti različita, ali je u standardnim uvjetima jednaka 1,976 kg / m3. To jest, ako je u plinovitom obliku, au drugim stanjima (tekućina / plin), vrijednosti gustoće također će biti različite. Ova tvar je kiseli oksid, njegov dodatak vodi rezultira ugljičnom kiselinom. Ako kombinirate ugljični dioksid s bilo kojom lužinom, tada reakcija koja slijedi formira karbonate i hidrokarbonate. Ovaj oksid ne može podnijeti izgaranje, uz nekoliko iznimaka. To su aktivni metali iu reakciji te vrste uzimaju kisik iz njega.
Jedan je od proizvoda propadanja ili spaljivanja bilo kojeg organska tvar. Otopi se u vodi samo na temperaturi od 15 ° C i samo ako je omjer vode i ugljičnog dioksida 1: 1. Gustoća ugljičnog dioksida može biti različita, ali je u standardnim uvjetima jednaka 1,976 kg / m3. To jest, ako je u plinovitom obliku, au drugim stanjima (tekućina / plin), vrijednosti gustoće također će biti različite. Ova tvar je kiseli oksid, njegov dodatak vodi rezultira ugljičnom kiselinom. Ako kombinirate ugljični dioksid s bilo kojom lužinom, tada reakcija koja slijedi formira karbonate i hidrokarbonate. Ovaj oksid ne može podnijeti izgaranje, uz nekoliko iznimaka. To su aktivni metali iu reakciji te vrste uzimaju kisik iz njega.
recepcija
Ugljični dioksid i neki drugi plinovi emitiraju se u velikim količinama kada se proizvodi alkohol ili se razgrađuju prirodni karbonati. Zatim se nastali plinovi isperu kalijev karbonat. Nakon toga slijedi apsorpcija ugljičnog dioksida, proizvod ove reakcije je bikarbonat, kada se otopina zagrije, dobiva se željeni oksid.  Ali sada je uspješno zamijenjen etanolaminom otopljenim u vodi, koji apsorbira ugljični monoksid koji se nalazi u dimnim plinovima i oslobađa ga kada se zagrijava. Ovaj plin je također nusproizvod reakcija u kojima se proizvodi čisti dušik, kisik i argon. U laboratoriju se dobiva ugljični dioksid kada interakcije karbonata i bikarbonata s kiselinama. Također je nastala kad su reagirali soda za pečenje i sok od limuna ili isti natrijev bikarbonat i ocat (fotografija).
Ali sada je uspješno zamijenjen etanolaminom otopljenim u vodi, koji apsorbira ugljični monoksid koji se nalazi u dimnim plinovima i oslobađa ga kada se zagrijava. Ovaj plin je također nusproizvod reakcija u kojima se proizvodi čisti dušik, kisik i argon. U laboratoriju se dobiva ugljični dioksid kada interakcije karbonata i bikarbonata s kiselinama. Također je nastala kad su reagirali soda za pečenje i sok od limuna ili isti natrijev bikarbonat i ocat (fotografija).
primjena
Prehrambena industrija ne može bez uporabe ugljičnog dioksida, gdje je poznata kao konzervans i prašak za pecivo, koji ima oznaku E290. Njegova u obliku tekućine sadrži aparat za gašenje požara.  Također, tetravalentni ugljikov oksid, koji se oslobađa tijekom fermentacije, služi kao dobra hrana za akvarijske biljke. Sadržana je u dobro poznatoj sodi, koju mnogi često kupuju u trgovini. Zavarivanje žicom odvija se u okolišu ugljičnog dioksida, ali ako je temperatura ovog procesa vrlo visoka, onda je popraćena disocijacijom ugljičnog dioksida, pri čemu se oslobađa kisik, oksidirajući metal. Zatim zavarivanje nije potpuno bez dezoksidanata (mangan ili silicij). Biciklistički kotači s ugljičnim dioksidom, također su prisutni u limenkama pneumatskog oružja (ova vrsta cilindra se zove). Također, ovaj oksid u čvrstom stanju, nazvan suhi led, potreban je kao rashladno sredstvo u trgovini, istraživanju i popravku neke opreme.
Također, tetravalentni ugljikov oksid, koji se oslobađa tijekom fermentacije, služi kao dobra hrana za akvarijske biljke. Sadržana je u dobro poznatoj sodi, koju mnogi često kupuju u trgovini. Zavarivanje žicom odvija se u okolišu ugljičnog dioksida, ali ako je temperatura ovog procesa vrlo visoka, onda je popraćena disocijacijom ugljičnog dioksida, pri čemu se oslobađa kisik, oksidirajući metal. Zatim zavarivanje nije potpuno bez dezoksidanata (mangan ili silicij). Biciklistički kotači s ugljičnim dioksidom, također su prisutni u limenkama pneumatskog oružja (ova vrsta cilindra se zove). Također, ovaj oksid u čvrstom stanju, nazvan suhi led, potreban je kao rashladno sredstvo u trgovini, istraživanju i popravku neke opreme.
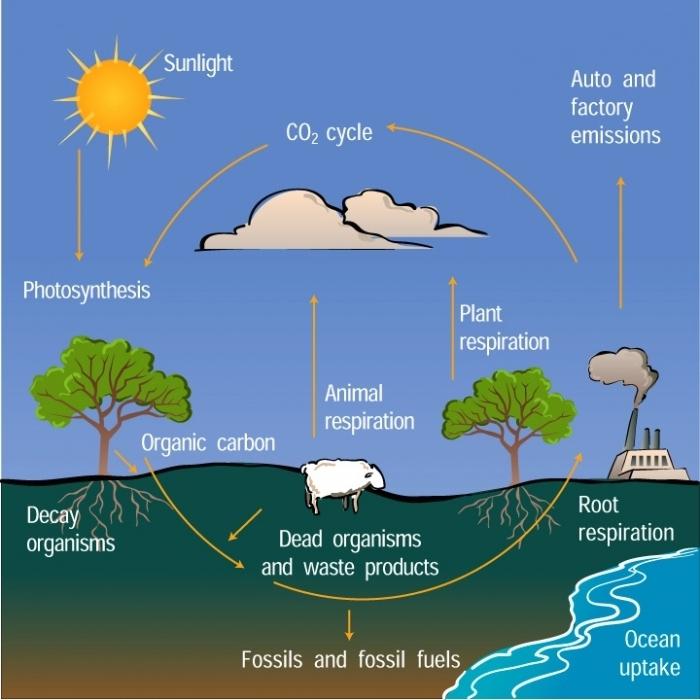 zaključak
zaključak
To je ono što je ugljični dioksid dobar za ljude. I ne samo u industriji, ona također igra važnu biološku ulogu: bez nje, ne može doći do izmjene plina, regulacije vaskularnog tonusa, fotosinteze i mnogih drugih prirodnih procesa. Ali prekomjerna količina ili nedostatak zraka za neko vrijeme može negativno utjecati na fizičko stanje svih živih organizama.