Primanje fenola. Struktura, svojstva i upotreba fenola
Fenoli su jednostavni organska tvar na bazi benzena. Pod normalnim uvjetima, to su krute toksične tvari specifičnog mirisa. U suvremenoj industriji ovi kemijski spojevi igraju značajnu ulogu. U pogledu upotrebe, fenol i njegovi derivati su među dvadeset najtraženijih kemijskih spojeva u svijetu. Široko se primjenjuju u kemijskoj i lakoj industriji, farmaceutskoj industriji i energetici. Stoga je proizvodnja fenola u industrijskim razmjerima jedan od glavnih zadataka kemijske industrije.
Oznake fenola
Početni naziv fenola je karbolna kiselina. Kasnije je ovaj spoj naučio ime "fenol". Formula ove tvari prikazana je na slici: 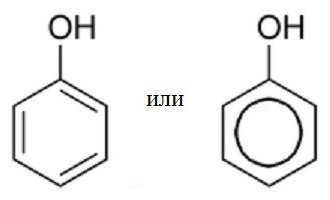
Numeriranje fenolnih atoma je iz ugljikovog atoma koji je povezan s hidroksilnom skupinom OH. Sekvenca se nastavlja tako da ostali supstituirani atomi dobiju najmanji broj. Derivati fenola postoje u obliku tri elementa, čija se svojstva objašnjavaju razlikom u njihovim strukturnim izomerima. Različiti orto-, meta-, parakrezoli su samo modifikacija osnovne strukture spoja benzenskog prstena i hidroksilne skupine, čija je osnovna kombinacija fenol. Formula ove tvari u kemijskom zapisu izgleda kao C6H5OH.
Fizikalna svojstva fenola
Vizualno, fenol je kruti, bezbojni kristali. Na otvorenom, oni oksidiraju, dajući supstanci karakterističnu ružičastu nijansu. U normalnim uvjetima, fenol je prilično slabo topljiv u vodi, ali kako temperatura raste do 70 ° C, ta brojka naglo raste. U alkalnim otopinama ova tvar je topiva u svim količinama i na svim temperaturama.  Ta svojstva su zadržana u drugim spojevima, čija je glavna komponenta fenoli.
Ta svojstva su zadržana u drugim spojevima, čija je glavna komponenta fenoli.
Kemijska svojstva
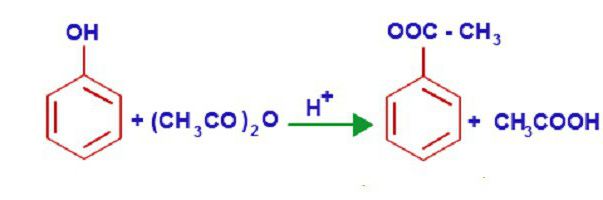
Jedinstvena svojstva fenola objašnjavaju se unutarnjom strukturom. U molekuli ove kemikalije, p-orbital kisika tvori jedan p-sustav s benzenskim prstenom. Takva gusta interakcija povećava elektronsku gustoću aromatskog prstena i smanjuje taj indeks na atomu kisika. U ovom slučaju, polaritet veza hidrokogrupe se značajno povećava, a vodik u njegovom sastavu lako se zamjenjuje bilo kojim alkalni metal. Tako nastaju različiti fenolati. Ovi spojevi se ne razgrađuju s vodom, kao alkoholati, ali su njihove otopine vrlo slične solima jakih baza i slabih kiselina, tako da imaju prilično izraženu alkalnu reakciju. Fenolati stupaju u interakciju s raznim kiselinama, a fenoli se obnavljaju kao rezultat reakcije. Kemijska svojstva ovog spoja omogućavaju interakciju s kiselinama, tvoreći estere. Na primjer, interakcija fenola i octene kiseline dovodi do stvaranja vinil estera (feniacetata).
Reakcija nitriranja široko je poznata, u kojoj fenol tvori smjesu para- i ortonitrofenola pod utjecajem 20% dušične kiseline. Ako djelujete na koncentrirani fenol dušična kiselina, To stvara 2,4,6-trinitrofenol, koji se ponekad naziva pikrinskom kiselinom. 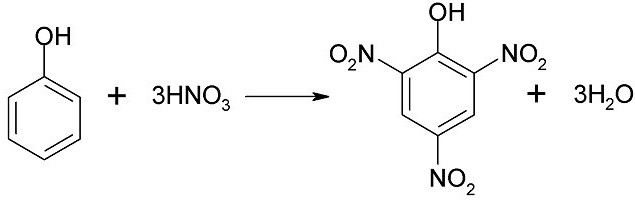
Fenol u prirodi
Kao samostalna tvar, fenol u prirodi sadržan je u ugljenom katranu iu nekim vrstama ulja. Ali za industrijske potrebe taj broj ne igra nikakvu ulogu. Stoga je dobivanje fenola na umjetan način postao prioritet za mnoge generacije znanstvenika. Srećom, taj je problem riješen i na kraju je dobiven umjetni fenol.
Dobivanje nekretnina
Upotreba različitih halogena omogućuje dobivanje fenolata iz kojih se formira benzen tijekom daljnje obrade. Primjerice, grijanje natrijev hidroksid i klorobenzen vam omogućuje da dobijete natrijev fenolat, koji se pri izlaganju kiselini razgrađuje u sol, vodu i fenol. Formula za ovu reakciju je dana ovdje:
C6H5-Cl + 2NaOH-> C6H5-ONa + NaCl + H20
Aromatične sulfonske kiseline također su izvor za proizvodnju benzena. Kemijska reakcija se provodi uz istodobno taljenje alkalnih i sulfonskih kiselina. Kao što se može vidjeti iz reakcije, fenoksidi se prvo formiraju. Tijekom obrade jake kiseline reduciraju se na poliatomske fenole.
Fenol u industriji
U teoriji, proizvodnja fenola na najjednostavniji i najperspektivniji način izgleda ovako: pomoću katalizatora se benzen oksidira s kisikom. Ali do sada katalizator za ovu reakciju nije odabran. Stoga se u industriji trenutno koriste druge metode.
Kontinuirana industrijska metoda za proizvodnju fenola sastoji se u interakciji klorbenzena i 7% otopine natrijevog hidroksida. Dobivena smjesa prolazi kroz sustav od 1,5 km cijevi koje se zagrijavaju na temperaturu od 300 ° C. Pod utjecajem temperature i održava visoki tlak, polazni materijali reagiraju, što rezultira proizvodnjom 2,4-dinitrofenola i drugih proizvoda. 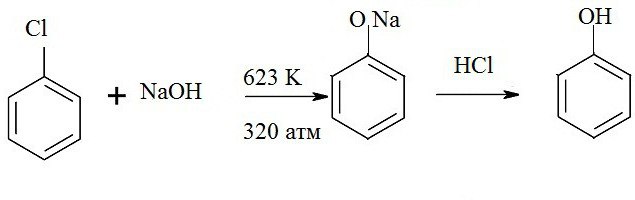
Ne tako davno razvijena je industrijska metoda za proizvodnju tvari koje sadrže fenol kumenskom metodom. Taj se proces sastoji od dvije faze. Najprije se iz benzena dobije izopropil benzen (kumen). U tu svrhu, benzen je alkiliran s propilenom. Reakcija je sljedeća: 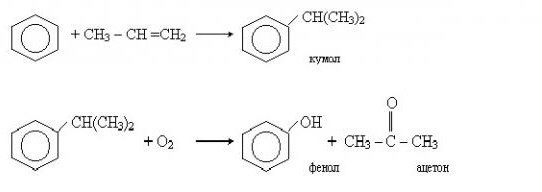
Nakon toga se kumin oksidira s kisikom. Na izlazu iz druge reakcije dobivaju se fenol i još jedan važan produkt, aceton.
Proizvodnja fenola u industrijskom mjerilu moguća je iz toluena. Da bi se to postiglo, toluen se oksidira na kisiku koji se nalazi u zraku. Reakcija se odvija u prisutnosti katalizatora.
Primjeri fenola
Najbliži homolozi fenola nazivaju se krezoli. 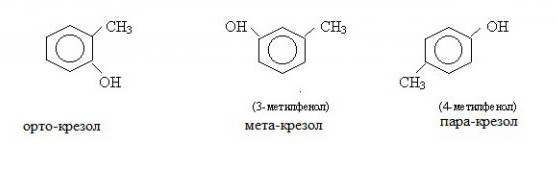
Postoje tri vrste krezola. Meta-krezol je tekućina pod normalnim uvjetima, para-krezol i orto-krezol su krute tvari. Svi krezoli su slabo topljivi u vodi, a njihova kemijska svojstva gotovo su jednaka fenolu. U svom prirodnom obliku, krezoli se nalaze u ugljenom katranu, u industriji se koriste u proizvodnji boja i nekih vrsta plastike.
Primjeri dijatomejskih fenola su para-, orto- i meta-hidrobenzeni. Svi oni su krute tvari, lako se otapaju u vodi.
Jedini predstavnik triatomskog fenola je pirogalol (1,2,3-trihidroksibenzen). Njegova je formula prikazana u nastavku. 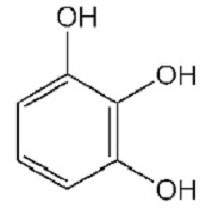
Pirogalol je prilično jak redukcijski agens. Lako se oksidira, pa se koristi za dobivanje plinova bez kisika. Ova je tvar dobro poznata fotografima, koristi se kao razvojni inženjer.