Peptidno spajanje je osnova primarne strukture proteina. Karakterizacija i stvaranje peptidnih veza
Peptidna veza je jaka veza između fragmenata dviju aminokiselina koja je temelj za formiranje linearnih proteinske strukture i peptidi. U takvim molekulama, svaka aminokiselina (s iznimkom terminalnih) je kombinirana s prethodnom i sljedećom.
Ovisno o broju veza, peptidne veze mogu stvoriti dipeptide (sastoje se od dvije aminokiseline), tripeptida (od tri), tetrapeptida, pentapeptida, itd. Kratki lanci (od 10 do 50 monomera) nazivaju se oligopeptidi, a dugi - polipeptidi i proteini ( mol. težine više od 10 tisuća.
Karakteristike peptidne veze
Peptidna veza je kovalentni kemijski spoj između prvog ugljikovog atoma jedne aminokiseline i dušikovog atoma drugog, koji je rezultat interakcije alfa-karboksilne skupine (COOH) s alfa-amino skupinom (NH2). Kada se to dogodi, nukleofilna supstitucija OH-hidroksila na amino skupini, iz koje se izdvaja vodik. Kao rezultat, formira se jedna CN veza i molekula vode.
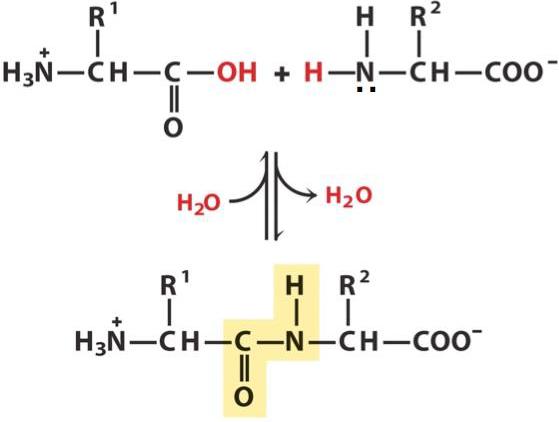
Budući da su tijekom reakcije izgubljene neke komponente (OH skupine i atom vodika), peptidne jedinice se više ne nazivaju aminokiselinama, već aminokiselinskim ostacima. Zbog činjenice da potonji sadrže svaki od 2 ugljikova atoma, u peptidnom lancu dolazi do izmjene veza C-C i CN, koje tvore peptidnu osnovicu. Na njegovim stranama nalaze se aminokiselinski radikali. Udaljenost između atoma ugljika i dušika varira od 0,132 do 0,127 nm, što ukazuje na neodređenu vezu.
Peptidna veza je vrlo snažan oblik kemijske interakcije. Pod standardnim biokemijskim uvjetima koji odgovaraju staničnom okruženju, on nije podložan samouništenju.
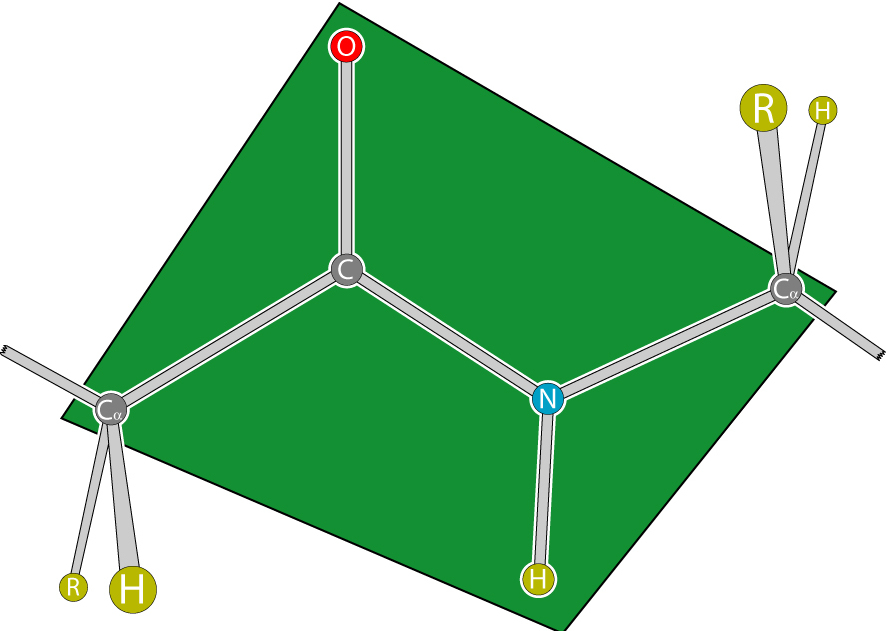
Peptidna veza proteina i peptida karakterizirana je svojstvom koplanarnosti, budući da su svi atomi uključeni u njegovu formaciju (C, N, O i H) smješteni u istoj ravnini. Ovaj fenomen se objašnjava krutošću (tj. Nemogućnošću rotiranja elemenata oko veze) koja je rezultat rezonantne stabilizacije. Unutar lanca aminokiselina između ravnina peptidnih skupina su a-ugljikovi atomi povezani s radikalima.
Vrste konfiguracija
Ovisno o položaju alfa-ugljikovih atoma u odnosu na peptidnu vezu, potonji može imati 2 konfiguracije:
- "cis" (nalazi se na jednoj strani);
- "trance" (s različitih strana).
Trans oblik je otporniji. Ponekad su konfiguracije karakterizirane položajem radikala, što ne mijenja bit, jer su povezani s alfa-ugljikovim atomima.
Pojava rezonancije
Osobitost peptidne veze je da je 40% dualna i može biti u tri oblika:
- Ketol (0,132 nm) - CN-veza stabilizirana je i potpuno jednostruka.
- Prijelazni ili mezomerno - međuproizvod ima djelomično neodređen.
- Enol (0.127 nm) - peptidna veza postaje potpuno dvostruka, a C - O spoj potpuno jednostruka. U tom slučaju kisik dobiva djelomično negativan naboj, a atom vodika - djelomično pozitivan.
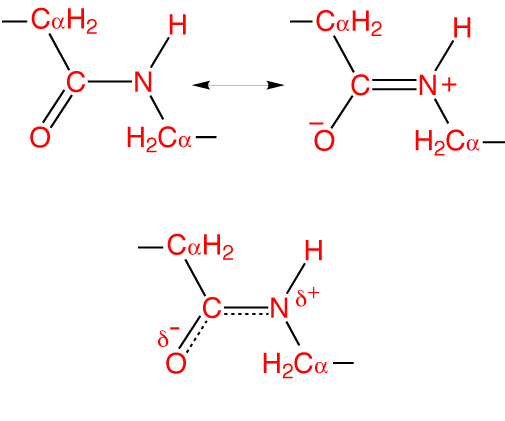
Ta se značajka naziva rezonantni učinak i objašnjava se delokalizacijom kovalentne veze između atoma ugljika i dušika. U ovom slučaju, hibridne sp 2 orbitale tvore elektronski oblak koji se širi na atom kisika.
Stvaranje peptidne veze
Formiranje peptidne veze je tipična reakcija polikondenzacije, koja je termodinamički nepovoljna. U prirodnim uvjetima, ravnoteža se pomiče prema slobodnim aminokiselinama, stoga je za izvođenje sinteze potreban katalizator koji aktivira ili modificira karboksilnu skupinu radi lakšeg održavanja hidroksila.
U živoj stanici nastaje peptidna veza u središtu sinteze proteina, gdje specifični enzimi djeluju kao katalizator, radeći s potrošnjom energije visokoenergetskih veza.